ある時間ないに反応物がどれくらい減少したか、生成物がどれくらい増加したかで化学反応の速さを示すことができる。化学反応では、ある物質が増加すると、一方である物質が減少する(図)。
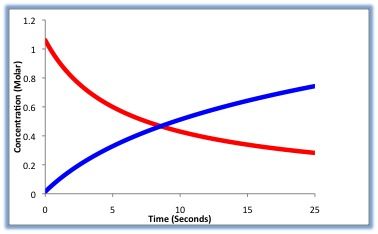
反応の速さの求め方
ある一定時間(⊿t)の間に、ある物質の濃度が⊿c(mol/L)変化する時(反応量と呼ぶ)、この反応の速さを次の式で表す。
|⊿c / ⊿t|[ mol/(L・S)]
※単位のSは秒(second)を表している。
例題:H2 + I2 →2HIの反応が以下のように起こった場合、反応速度を求めよ。
始めのH2濃度 → 10秒後のH2濃度
1.0mol/L → 0.1mol/L
物質量の変化、時間の変化をそれぞれ抽出すると・・・
反応量: 0.1 – 1.0 = -0.9mol/L
時間の変化:10s
よって、反応の速度は-0.09[ mol/(L・S)]となる。
また量的関係から言って、H2分子1つが減少すると HI分子が2つできるので、HI分子の反応速度は、0.18[ mol/(L・S)]であることがわかる。
I2も同様に考えて、H2分子1つが減少すると、I2分子1が減少するので、I2分子の反応速度は-0.09[ mol/(L・S)]である。
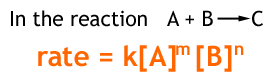
Thank you for your feedback. I’m so glad that you have not experienced the same issues as before, recently.You are absolutely right that the amount of time was inexcusable. These changes that took place are BIG. Testing had to be extensive so that our customers’ sites were not caused serious problems to their fuoaYinnclity.tes. We have had since then a serious change in customer relations policy. You should now find that customer service does not carry this same attitude.
I’m so glad I found my soitulon online.