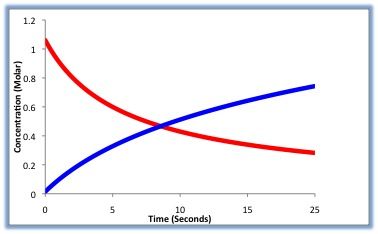
反応速度と濃度
反応の速さと、反応物の濃度の関係を表す式を反応速度式と呼ぶ。物質の濃度が高ければ高いほど、物質同士が衝突する確率は高くなるため、反応速度vは速くなる
反応速度式の書き方
計測された時間⊿t における反応速度はそれぞれの物質の濃度の掛けた数に比例することが実験で確かめられている。そのため反応速度は反応物濃度を使って次の式で表すことができる
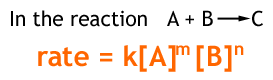
[A]、[B]:モル濃度
[A]と[B]はそれぞれの物質の濃度である。化学反応が進むということは、物質同士が衝突するという意味と等しいので、濃度が高ければ高いほど、反応速度は大きくなる。
k:反応速度定数
kは反応速度定数と呼ばれる。反応速度定数とは、その条件の化学反応によって決まる定数である。高ければ高いほど、化学反応の速度が早くなる(=化学反応の速さが早いと反応速度定数も大きい)。比例速度係数は温度が10K上昇すると、2~3倍になることが知られている。
m+n:反応次数
mとnの和は反応次数と呼ばれる(x、y等でも表現する)。そのその合計値によってその反応系の名称が異なる。反応字数の和が1の場合、一次反応と呼ぶ。反応次数の和が2の場合、2次反応と呼ぶ。ちなみに次の式は三次反応である。
v = k[A][B]2
このmやnの数は熱や圧力によって変化するため、化学反応式に必ずしも一致するとは限らない。そのため、実験によって求める必要がある。
例題
A+B→Cで表される化学反応がある。次の実験結果が得られた場合、Cの生成速度を反応速度式で示せ。
【実験結果】
Aのモル濃度を2倍にすると、Cの生成速度も2倍になる。
Bのモル濃度を1/2倍にすると、Cの生成速度は1/4倍になる。
Aのモル濃度を2倍にすると、Cの生成速度も2倍になることから、[A]の次数は1であると考えられる。
一方、Bのモル濃度を1/2にすると、Cの生成速度は1/4倍になることから、[B]の次数は2であると考えられる。
[B]2だと考えると、濃度が1mol/Lの場合は1 × 1= 1一方、Bのモル濃度を1/2にすると、Cの生成速度は1/4倍になることから、[B]の次数は2であると考えられる。
1/2濃度の1/2mol/Lの場合は、1/2 × 1/2 = 1/4と、1/4になる現象に説明がつく。
よって、 v = k[A][B]2の式だと考えられる。