Contents
硫黄の化合物
硫黄の代表的な化合物には、二酸化硫黄SO2、三酸化硫黄SO3、硫酸H2SO4、硫化水素H2Sなどがある。硫黄原子は様々な酸化数を取ることができる。H2Sは酸化数をこれ以上減らすこと(還元すること)はできないので、相手を還元する還元剤として働く。一方、H2SO4はこれ以上酸化数を増やすこと(酸化すること)ができないので、相手を酸化する酸化剤として働く。
二酸化硫黄SO2
無色の刺激臭のある有毒な気体である。水に良く溶けて、亜硫酸H2SO3を生成する。還元作用があり、漂白作用がある(還元剤として働く)。H2Sに対しては酸化剤として働く
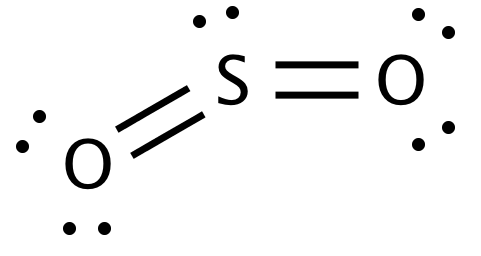
http://chemistry.stackexchange.com/
三酸化硫黄SO3
三酸化硫黄は水に溶かすと硫酸となるため大量に工業生産されている。酸性雨の原因にもなっている。

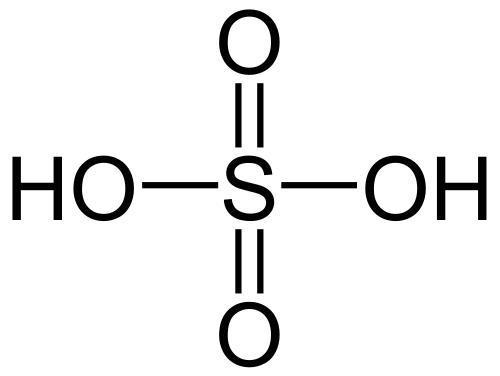
硫酸H2SO4
硫酸には濃硫酸、希硫酸の2種類があり性質が異なる。濃硫酸は質量パーセント濃度が90%以上、希硫酸は質量パーセント濃度が90%未満の硫酸水溶液を指す。
https://www.restauro-online.com/
濃硫酸の性質
無色の重い気体で、水を入れることで激しく発熱する。吸湿性が高い。また、脱水作用があり、様々な物質からHとOを2:1の割合で奪い取る。
熱濃硫酸は酸化作用が強く、Cuなどとは酸化剤として反応し、SO2を生成する。
希硫酸の性質
弱酸性の液体で、多くの金属を溶かしてH2を発生させる。硫酸塩の多くは水に溶ける。しかし、CaSO4、SrSO4、BaSO4、PbSO4は水に難溶である。
硫酸の製法
SO2とO2を反応させて(触媒は五酸化バナジウムV2O5)、SO3を生成する。SO3を濃硫酸に吸収させて発煙硫酸(濃硫酸にSO3を過剰に吸収させたもの)とする。

発煙硫酸に希硫酸を加えて、SO3と希硫酸中の水分子を反応させて濃硫酸とする。この方法を接触法と呼ぶ。
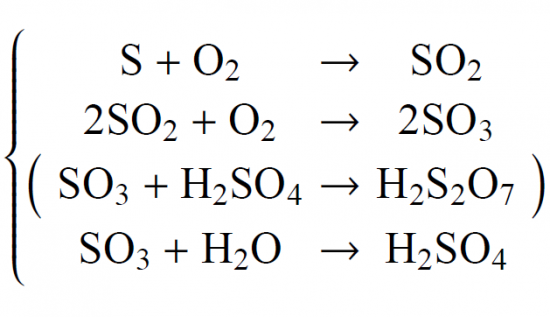
硫化水素H2S
無色で、腐卵臭の有毒な気体である。以下のような性質がある。
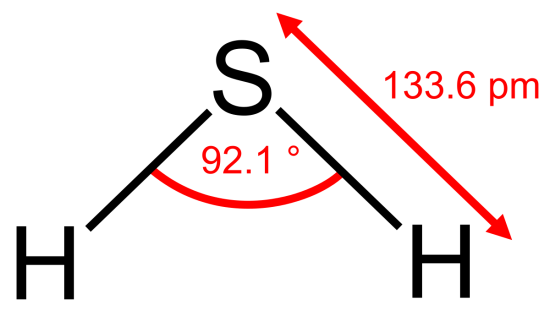
①水溶液は弱酸性を示す。
H2S→2H + S2-
②可燃性である。
H2S + O2 → H2O + SO2
③還元剤として用いられる。
H2S + I2 → S + 2HI (Sの酸化数が-2から0に増えている=自身は酸化している)。
④多くの金属イオンと反応し、硫化物を生成する。
Pb2+ + H2S → PbS(黒) + 2H+
Cu2+ + H2S → CuS(黒) + 2H+
硫化水素の製法
硫化鉄(Ⅱ)FeSに希硫酸を加えて生成する。FeSは弱酸H2Sと塩基Fe(OH)2の塩である。そのため、H2Sよりも酸性が強い希硫酸を加えると、より強い酸と塩(FeSO4)を形成し、弱酸が遊離する。
FeS + H2SO4 → FeSO4 + H2S
希硫酸がない場合は塩酸でも良い。

Now I’m like, well duh! Truly thunafkl for your help.
Wow! Finally I got a weblog from where I can genuinely obtain helpful data concerning my study and knowledge.
Thanks for sharing your thoughts about vlog.
Regards
https://illinoistechcon.com/
Yes! Finally something about news.
https://tunnellracing.com/