カルボン酸ではカルボニル基が電子を引き寄せるから
アルコールはヒドロキシ基-OHを持つ炭化水素で、カルボン酸はカルボニル基に-OHが結合したカルボキシル基-COOHを持つ炭化水素です。
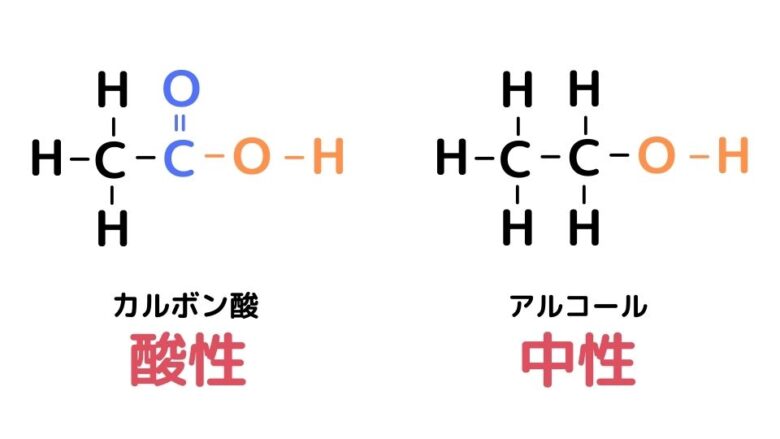
同じ-OHを持つのにアルコールは中性でカルボン酸は酸性です。この違いはどこからくるのでしょうか。原因は-OHが結合しているカルボニル基C=Oにあります。

酢酸を例に電離する仕組みを見てみましょう。
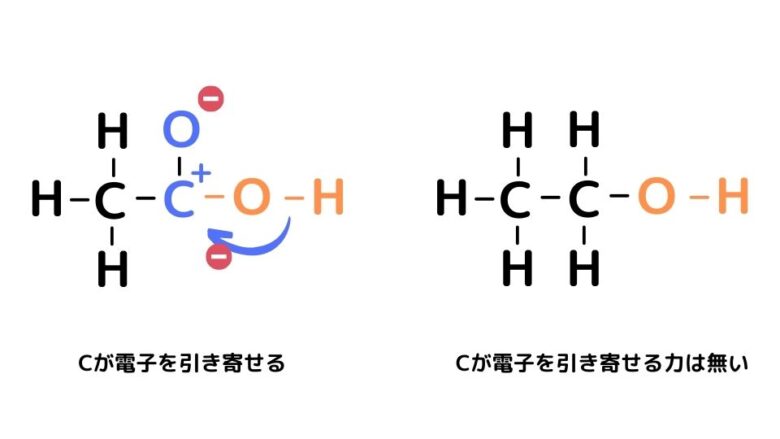
カルボン酸のカルボニル基はO側に電子が吸引されており、その結果、Cが+に帯電します。
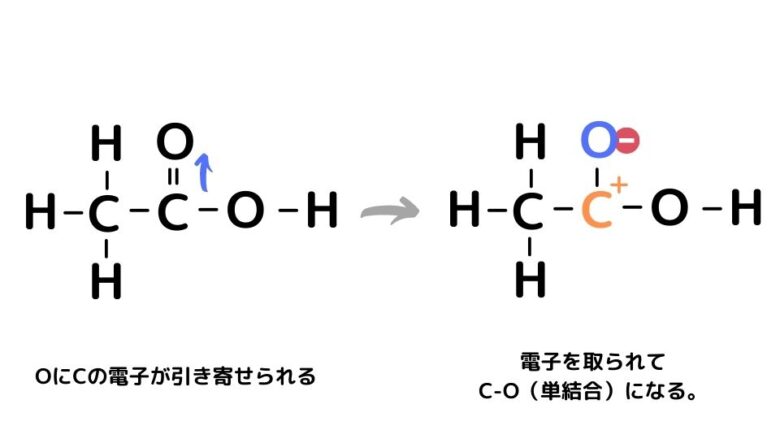
すると、隣のO-H結合から電子が流入し、H+が放出されます。
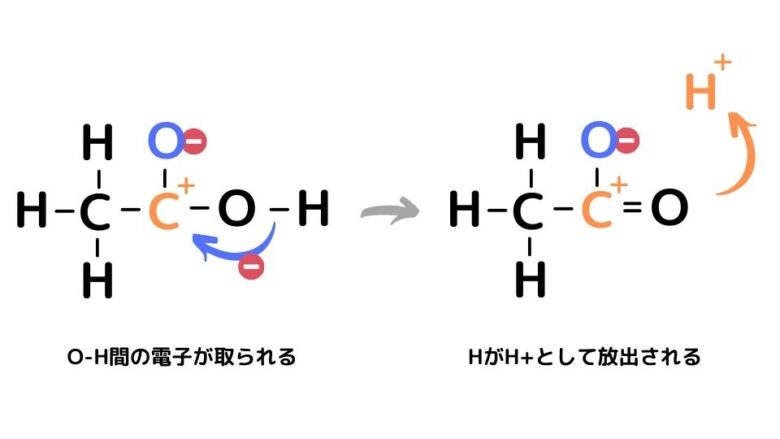
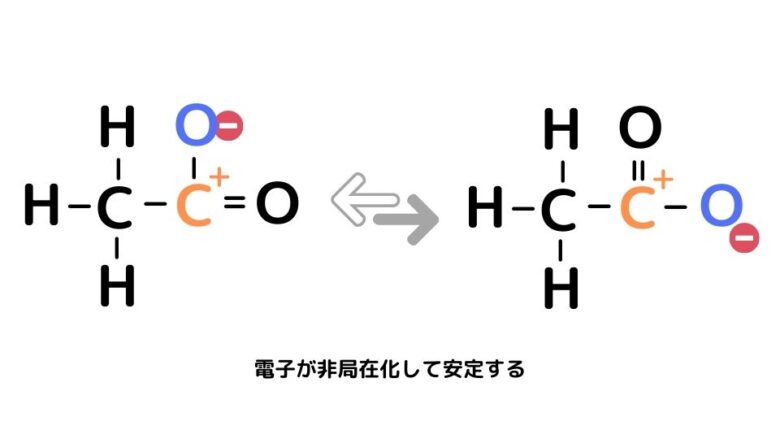
さらに-COO–は電子の場所が絶えず移動し、安定した構造となります。これを電子の非局在化と呼びます。

カルボン酸(下画像左)はCがO-Hの電子を引き寄せるけど、アルコール(下画像右)のCは電子を引っ張る力を持っていないからH+が電離しづらいんだね。