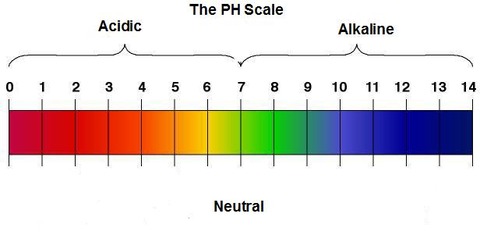
酸の強さを示すpH
pHとはH+の濃度がどれくらいあるか0~14の数字で示した値である。値が低ければ低いほど、H+の濃度は高く、酸性が強い。pH試験紙ではpHによって色合いが変化する
pHの求め方
pHは以下の式で求めることができる。
何故logなのか?
log10とは、10の何乗であるかという意味である。 なぜこんなものを使うかというと、視覚的に分かり易いからである。それ以上の理由はない。水素イオン濃度は極微量のため、0.00000000000001mol/Lなんて値も日常的に使われる。これをそのまま書くのは大変なので、まずは指数にする。
0.00000000000001mol/L = 10-13 mol/L
わざわざ10の何乗という形にするのも面倒なので、logで示すとさらに簡単になる。
log10 10-13 mol/L = -13
値にマイナスがつくのも不自然なので、全体に-をかけると次の式となる。
– log10 10-13 mol/L = 13
このようにすると、見やすく理解し易い。
また、水素イオンの濃度が10の何乗というような数ではない場合(b×10-a mol/L)は、通常通り-log10で求めればよいので、次の式のようになる。
pH = -log10(b×10-a) = -log10 b + a
例題
[H+] = 1.0 × 10-2 の溶液がある。pHを求めよ。
解き方
pH = – log10 (1.0 × 10-2 )
よって、pH = 2となる。
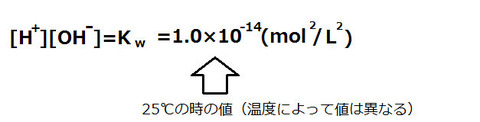
水のイオン積とpH
H+の濃度と、OH-の濃度を掛けたものは1.0×10-14(mol/L)2であり、これを水のイオン積と呼ぶ。温度が一定ならばこの値は変化しない。これを利用して、OH-の濃度からpHを求めることができる。
例題
[OH-] = 1.0 × 10-2 の溶液がある。pHを求めよ。
解き方
水のイオン積は下の式で求めることができるので代入すると、
[H+]×1.0 × 10-2 = 1.0×10-14(mol/L)2
[H+] = 1.0×10-12 mol/L
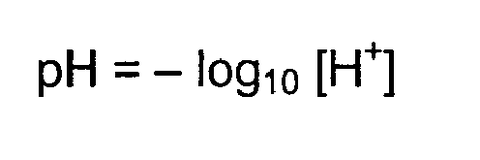
Fiaylln! This is just what I was looking for.