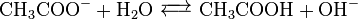電離平衡とは
電解質(水溶液中で電離する物質)では、電離していない電解質と電離で生じたイオンとの間に 次のような平衡状態が生じている。これを電離平衡と呼ぶ。
電離定数
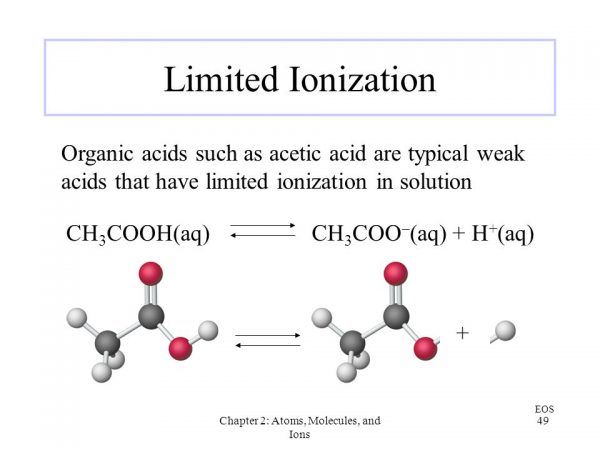
電離していない電解質と電離で生じたイオンの濃度を用いて平衡定数を求めたものを電離定数と呼ぶ。平衡定数と異なるのは、電離していない電解質と電離で生じたイオンにのみ注目するという点である。
![]()
上記の平衡反応においては電離度が極めて低いため、H2Oの増減はほぼない。そのため(定数となるため)、平衡定数に組み入れることができる。よって、電離定数Kbは次のようになる(酸の時はKa、塩基の時はKb)となる。
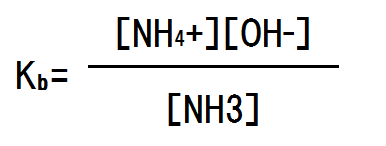
弱塩基(弱酸)の電離定数と電離度・イオン濃度
弱塩基・弱酸は殆ど電離しておらず、電離度が極めて低い。その性質を利用して、電離度やイオン濃度を求めることができる。
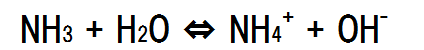
電離平衡を求める式は以下のようになる。
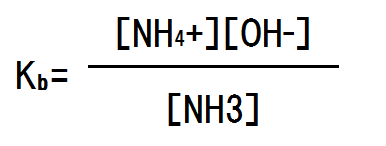
NH3の濃度をc mol/Lとし、電離度をαとすると、平衡時のNH3の濃度はc×(1-α)となり、NH4+の濃度はc×α、OH-の濃度はc×αとなる。電離定数を求める式に代入すると次のようになる。
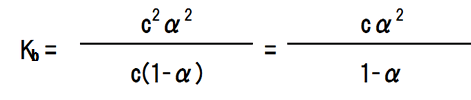
ここで、電離度αは極めて小さいので、無視できる範囲である。つまり、1-α = 1である。よって、以下のようになる。
![]()
また、変形すると電離度αを求めることができる。
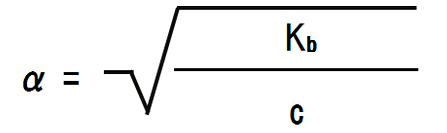
なぜ1 – α(電離度) = 1なのか
実際に1 – α = 1とせずに計算してみるとどれだけの差が生じるのだろうか。例えば、0.030(mol/L)の酢酸の電離度を0.030として電離定数を求めてみよう。
Ka = (cα)2 / c(1-α) = 2.78 × 10-5 = 2.8 × 10-5
Ka = cα2 = 2.7 × 10-5
下一桁が変化したが、これを極僅かな差と見るか、大きな差と見るかが重要である。通常の化学の量的関係ならば「大きな差」として処理するだろうが、平衡においては極僅かな差として処理する。そのため、1 – α = 1と見なして良いのである。
弱酸・弱塩基の電離度は、濃度が低くなればなるほど増加することが知られている。電離度が大きくなりすぎると、1 – α = 1とは見なせなくなり、計算式に組み込まなければならない。
電離定数とイオン濃度
OH-のイオン濃度は、c×αによって求められるので、上記の式α=√Kb/cを変形すると次の式が得られる。
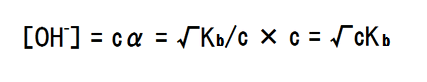
例題
0.010mol/Lの酢酸の電離度αと水素イオン濃度を求めよ。酢酸の電離定数を1.0×10-5 mol/Lとし、αは1に比べて非常に小さいものとする。
K = cα2なので、α = √K/cである。代入すると、
α = 0.032
また、水素イオン濃度はcαなので、
cα = 3.2 × 10-4 mol/L