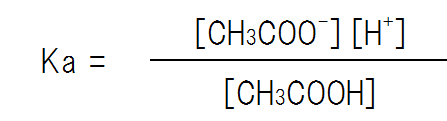溶解平衡とは
結晶の存在する飽和溶液では、溶解する速さと結晶として析出する速さが等しい。そのため、見かけ上は溶解も析出も起こっていないように見える。この状態を溶解平衡と呼ぶ。
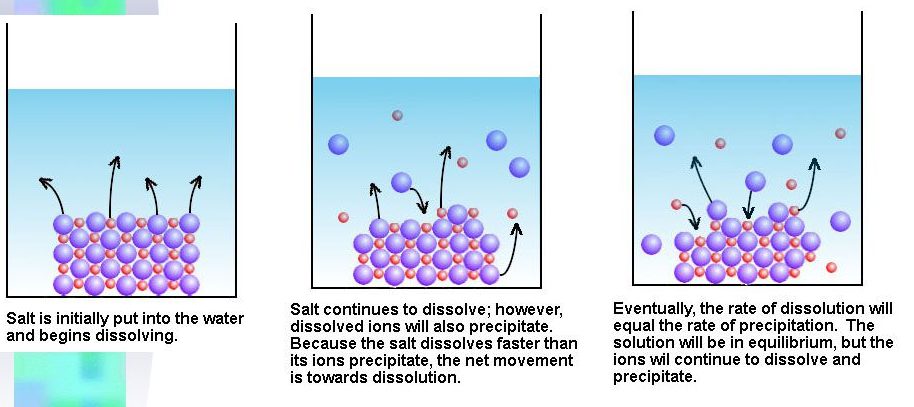
http://slideplayer.com/slide/5676892/
共通イオン効果
溶解平衡状態の時は、溶解平衡に関連するイオン(これを共通イオンと呼ぶ)を加えてやると平衡移動が起こる。これを共通イオン効果と呼ぶ。
例えば、NaClの飽和水溶液にHClを加えると、Clが共通イオンであるため、次の平衡の式が左向きに移動し、その結果、NaClの結晶が析出する。
NaCl(固)⇔ Na+ + Cl–
溶解度積
難溶性の塩AmBnが溶解平衡の状態にあるとき、その濃度の積が定数(Ksp)になる。これを溶解度積と呼び、その値は温度に依存する(溶解度は温度によって変化するため)。
Ksp = [An+]m[Bm-]n = 一定
例えば、クロム酸銀の溶解平衡は次のような溶解平衡に達する。
Ag2CrO4(固)⇔ 2Ag+ + CrO42-
溶解度積は次のようになる。なお、単位についてはその物質によって変化するため、その都度求める。
Ksp = [Ag+]2 [CrO42-] (mol/L)3
溶解度積と沈殿形成
難溶性の塩を構成するイオンを含む水溶液を混ぜた時に沈殿が形成するかどうかは、溶解度積から求めることができる。
例えば、AgClの水溶液を例として考えてみよう。AgClの溶解積は8.1×10-11(mol/L)2である。Ag+とCl–を含む次の2つの溶液を混ぜてみる。
- 0.10mol/L AgNO3 0.10L
- 0.10mol/L NaCl 0.20mL(0.00020L)
①[Ag+]を求める
Agの物質量は0.1mol/L×0.1Lである。水溶液は2つ合わせて、0.1002Lなので濃度は次のようになる。なお、0.0002Lは0.1Lに比べて十分に小さいため、0.10002L = 0.10Lとして計算してよい。
[Ag+] = 0.10mol×0.1L / 0.10002L = 0.10[mol/L]
②[Cl–]を求める。
Agの時と同様に、Cl-の濃度は次の式で求められる。
[Cl–] = 0.10mol×0.0002L / 0.10002L = 2.0×10-4 [mol/L]
③イオン濃度の積を溶解度積と比較する
問題文よりKsp=8.1×10-11なので、次のようになる。
[Ag+][Cl-] = 2.0 × 10-5 > Ksp = 8.1×10-11
Kspよりも溶解度積の方が大きいのでAgClの沈殿が生じる。なお、この沈殿は溶解度積がKspの値になるまで起こる。