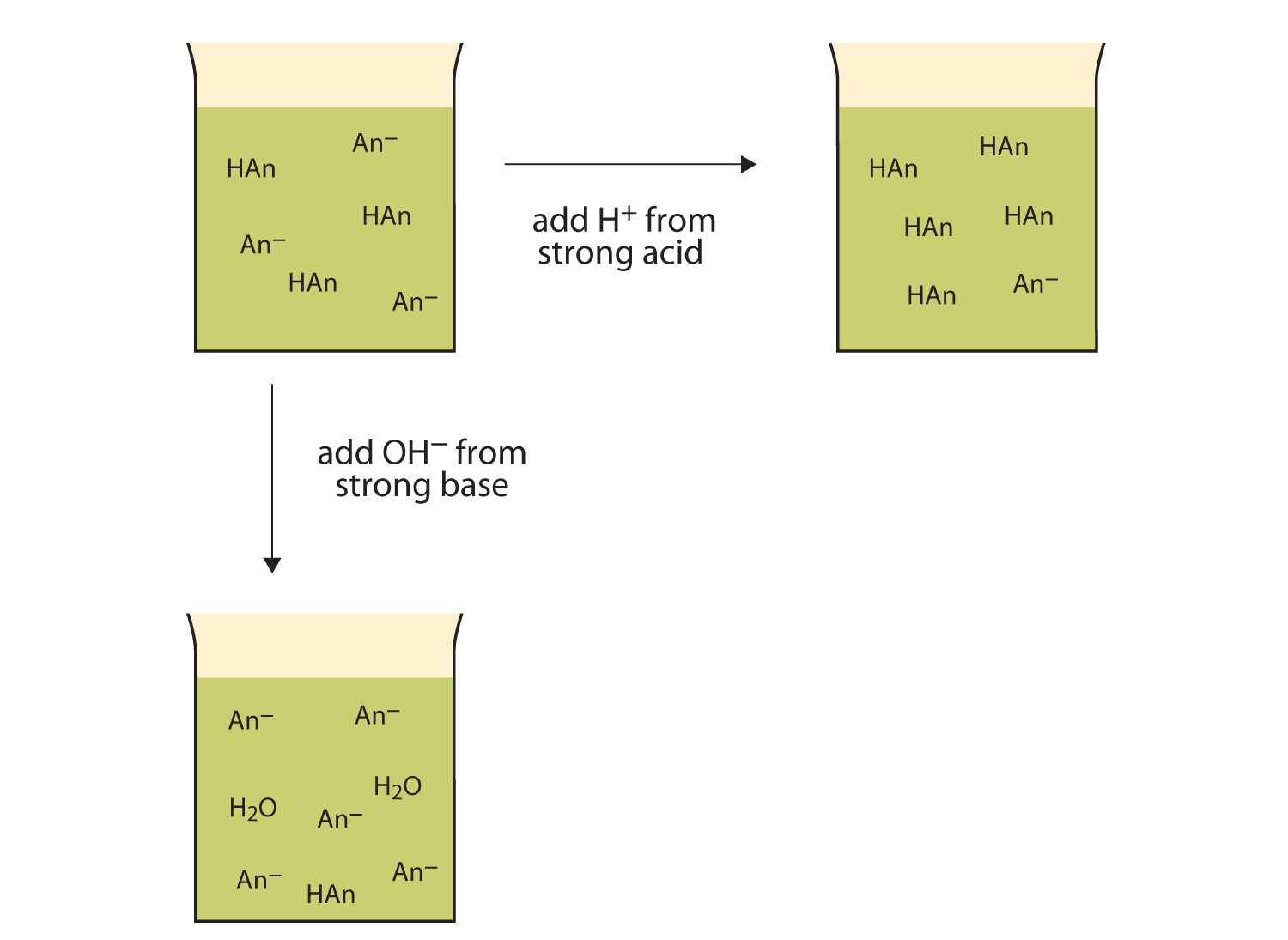
緩衝液とは
少量の酸や塩基を加えた時に、その影響を緩和し、pHが一定に保たれるような働きを持つ水溶液を緩衝液と呼ぶ。また、緩衝液が持つそのような働きを緩衝作用と呼ぶ。
https://catalog.flatworldknowledge.com/
緩衝液の例
一般的に、弱酸とその塩の水溶液、弱塩基とその塩の水溶液は緩衝液として働く。具体例と共に見てみよう。
酢酸と酢酸ナトリウムの混合溶液
酢酸と酢酸ナトリウムの水溶液にはCH3COOH(酢酸由来)と、CH3COO–(酢酸ナトリウム由来)が多量に含まれている。
酸を加えると、次の反応が起こり、H+が増加しない。この反応は酢酸は弱酸であるため、H+を加えることによって、平衡のバランスが右へと移行することによって起こる。
CH3COO– + H+ → CH3COOH
また、塩基を加えると次の反応が起こり、OH–が増加しない。この反応は単純に中和反応である。
CH3COOH + OH- → CH3COO– + H2O
高濃度の強酸・強塩基は、酸や塩基を加えてもあまりpHは変化しないが、緩衝液とは言わない。これらの水溶液は水で十分に希釈すれば、pHは低下するのである。しかし、pH = 4.7の酢酸ー酢酸ナトリウムの緩衝溶液は、[CH3COOH]/[CH3COO–]の比が変わらないため、10倍に希釈してもpHはほとんど変化しない。
緩衝液の[H+]の求め方
c[mol/L]の弱酸と、c'[mol/L]の塩を含む緩衝液について、CH3COOHとCH3COONaを例に考えてみよう。これらの混合水溶液には電離平衡として次の式が成り立っている。
CH3COOH ⇔ CH3COO– + H+
一般的に、水溶液中にいかなる分子が混在していても、弱酸とそのイオンが少しでも共存していれば、電離平衡が存在している。
始めのCH3COOHの濃度をc、CH3COO–の濃度をc’とすると、平衡時の濃度は次のようになる。
| CH3COOH | CH3COO– | H+ | |
| 始め | c | c’ | – |
| 平衡時 | c – x | c’ + x | x |
弱酸の電離平衡は次の式で求めるられる。
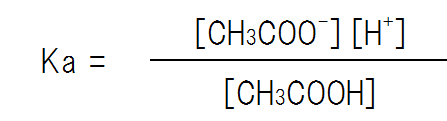
よって、H+の濃度は次のようになる。なお、この時、xはc、c’と比べて非常に小さな値のため、c – x = c、c’ + x = c’とみなす。
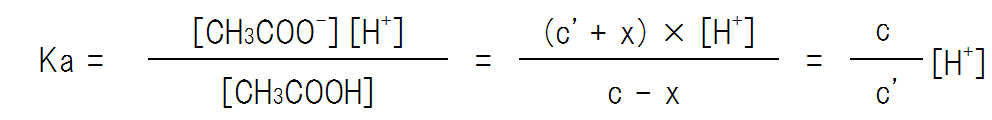
Ka = c / c’ [H+]なので、式を変形すると次のようになる。
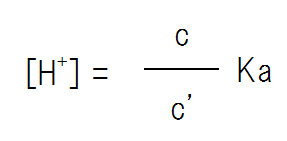
つまり、[H+]= Ka×(弱酸の濃度 / 塩の濃度) である。
緩衝液の[OH-]の求め方
続いてNH3とNH4Clの混合水溶液の緩衝液の[OH–]を求めてみよう。
始めのNH3の濃度をc、NH4+の濃度をc’とすると、平衡時の濃度は次のようになる。
| NH3 | NH4+ | OH– | |
| 始め | c | c’ | – |
| 平衡時 | c – x | c’ + x | x |
弱酸の時と同様に、弱塩基の平衡定数を求めると次のようになる。なお、この時、xはc、c’と比べて非常に小さな値のため、c – x = c、c’ + x = c’とみなす。
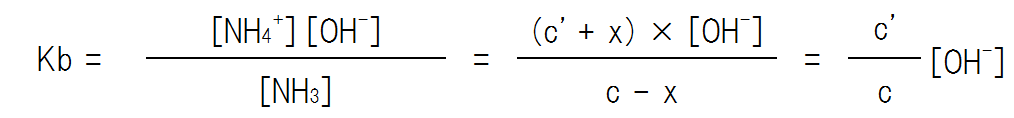
よって、OH–の濃度は次のようになる。
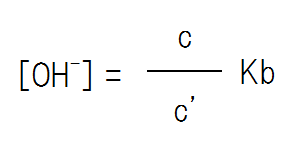
つまり、[OH–]= Kb×(弱塩基の濃度 / 塩の濃度) である。