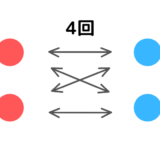
分子同士の衝突によって起こる反応ではないから
五酸化二窒素は45℃に熱すると分解して四酸化二窒素と酸素を生じます。
2N2O5 → 2N2O4 + O2
この反応速度式は実験によって求めると、次のようになることがわかっています。
v = k[N2O5]
普通、反応速度式の濃度の指数は、化学反応式の係数と一致することが多いです。なぜこの反応では、 v = k[N2O5]2のようにはならないのでしょうか。
この原因は、反応が分子同士の衝突によって起こるのではなく、触媒や容器の壁などとの衝突によって起こる反応であることに起因しています。
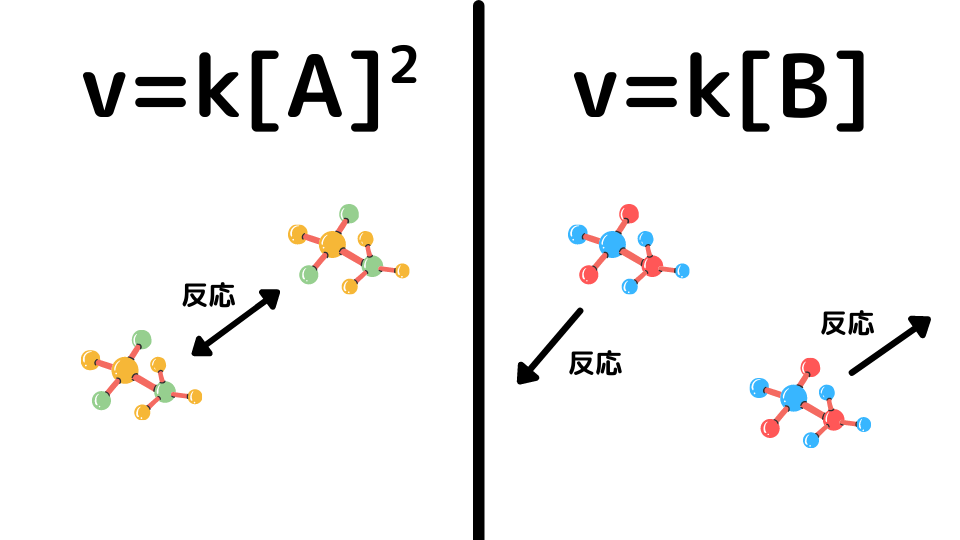

なぜ分子同士の衝突だと係数の累乗になるのかはこちらの記事をご覧ください。
 なぜヨウ化水素HIの分解反応の反応速度式の指数は二乗になるの?
なぜヨウ化水素HIの分解反応の反応速度式の指数は二乗になるの?
また、この反応には中間反応が多くありますが、実際には(i)が最も時間がかかる反応なので、(i)の反応速度に反応全体が作用されることになります。
N2O5→N2O3+O2…(i)
N2O3→NO+NO2…(ii)
N2O5+NO→3NO2…(iii)
4NO2→2N2O4…(iv)

反応機構をちゃんと理解していないと、反応速度式はわからないんだね!