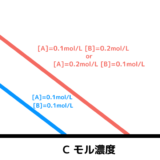
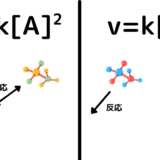
濃度が大きいほど衝突する回数が増え、濃度が小さいほど衝突する回数が減るから
次のような反応があったとします。
A + B → C
この場合、反応速度はAの粒子とBの粒子の衝突回数に依存し次の式で表すことができます。これを反応速度式と呼びます。
v = k[A][B]
なぜ掛け算になるのかは、実際に粒子の挙動を考えれば理解できます。例えば、Aの濃度を2倍にすると、Aの粒子がBの粒子に衝突する回数(可能性)は2倍になります。
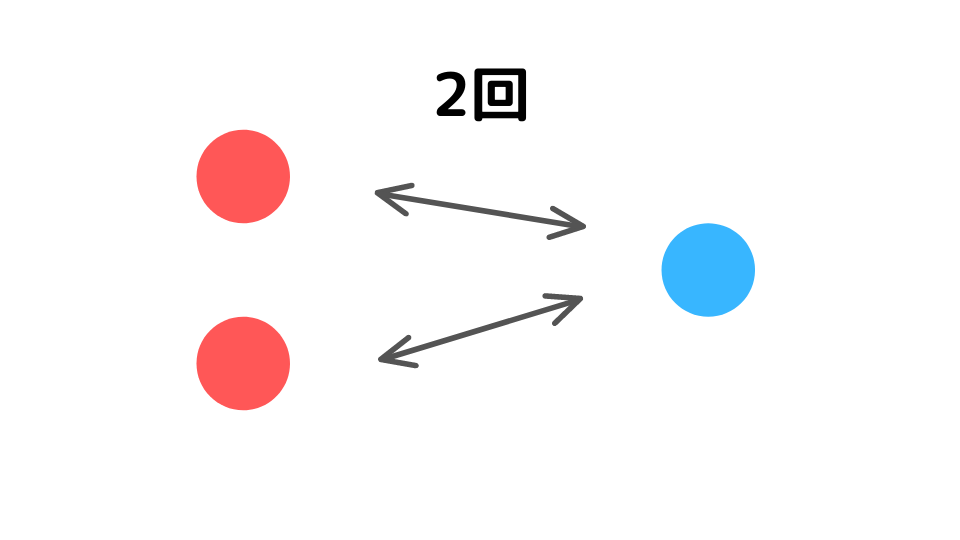
また、A、Bの濃度をそれぞれ2倍にすると、衝突する回数(可能性)は2×2=4倍になります。
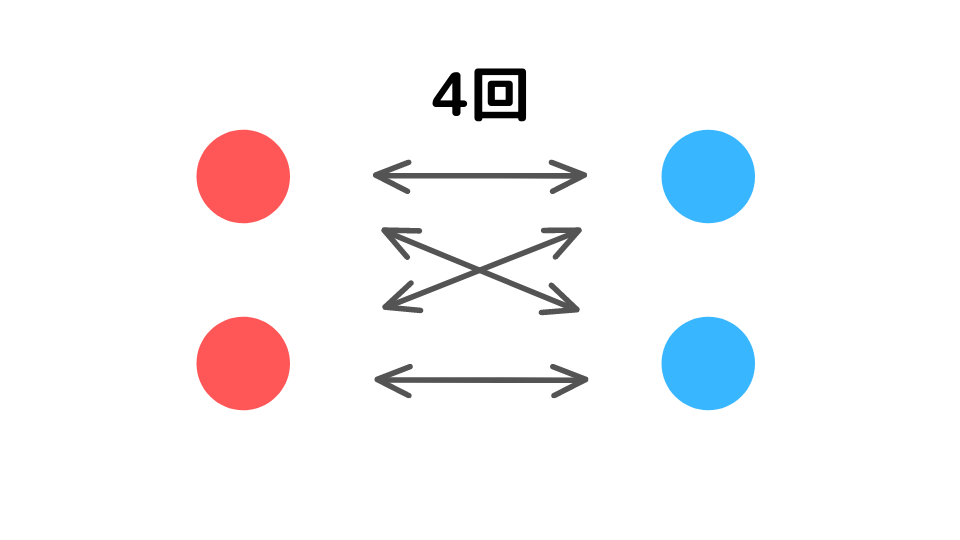
このように、粒子が増えると衝突する回数が濃度の積に比例することとなるため、[A]×[B]の比例関係が成り立ちます。
また、衝突したからといって全てが反応が起こるわけではないため、反応が起こる割合としてk(反応速度定数)を置きます。kは温度によって変化する定数です。