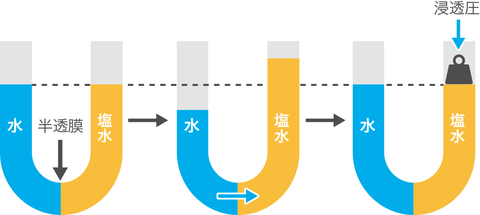
浸透圧
溶質の濃度が異なる溶液が半透膜を挟んで存在するとき、 濃度の低い方から高い方へ溶媒が移動する現象が起こる。これを浸透と呼ぶ。また、浸透(溶媒の移動)を抑えるために必要な圧力を浸透圧と呼ぶ。
http://www.shiojigyo.com/
ファントホッフの法則
浸透圧Π(パイ) 単位Paはモル濃度c(mol/L)と絶対温度T(K)に比例することが知られている。溶媒や溶質の種類には寄らない。また、この時の比例定数は気体定数Rと一致することが知られている。つまり、浸透圧は次のように表すことができる。
Π= cRT
(c=モル濃度(mol/L)、R=気体定数 8.3×103(Pa・L/K・mol)、T=絶対温度)
c = n(物質量mol) / V(体積L)なので、書き直すと次のようになる。
Π = n/V × RT
ΠV = nRT
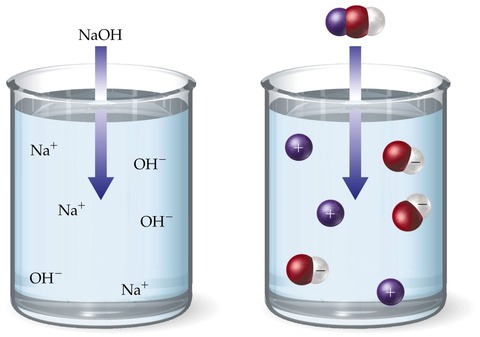
電解質溶液
溶質が電解質(溶液中で電離する物質)である場合、電離して粒子数が増加するため、同じ濃度の非電解質溶液よりも沸点上昇度が大きくなる。また、凝固点降下度、浸透圧も同様に大きくなる。