沈殿の生成
イオン結晶は一般的に水に溶けやすい(水和しやすい)ものが多いが、水に溶けにくいものがある。この理由については、単純には言えず様々な面から論じなければならない。
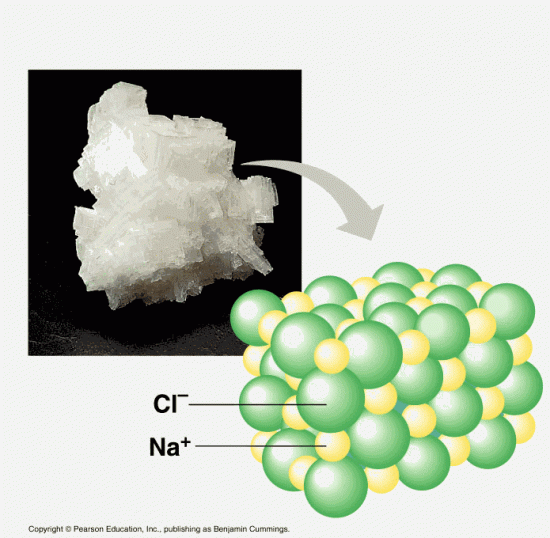
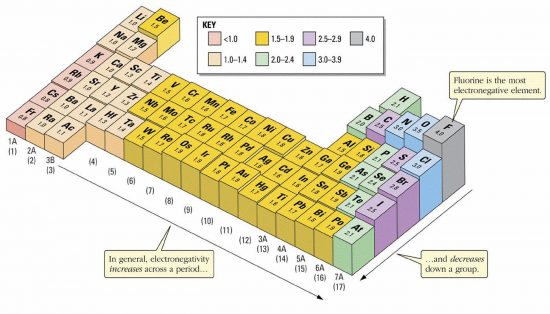
例えばAgCl(下画像)では、Clはハロゲンなので電気陰性度が大きく、3.16である。一方、Agも金属の中では電気陰性度が大きい方で1.9である。どちらも電気を引っ張る力が強く、共通結合性のイオン結合となっている。この結合を断ち切ってバラバラにするには、水の水和による力だけでは足らず、水に溶けないと考えられる。

一方NaClでは、ナトリウムの電気陰性度は0.93、Clの電気陰性度は3.16である。NaClは電子がしっかり偏っているため、完全なイオン結合である。そのため、水和しやすく水に溶けやすいと言える。
http://schools.birdville.k12.tx.us/
塩の種類
陰イオンと陽イオンの化合物を塩とよぶ。一般的な塩として硝酸塩、塩化物、硫酸塩、炭酸塩、クロム酸塩、酢酸塩がある。また一般的に、アルカリ金属の塩、アンモニウムイオンの塩、酢酸塩は全て水に溶けやすい。

http://www.huffingtonpost.com/
硝酸塩
金属を硝酸に溶かした際に生じる塩である。NaNO3、Mg(NO3)2、Cu(NO3)2…などがある。これら硝酸塩は全て水に溶けやすい。

塩化物
金属を塩酸に溶かした際に生じる塩である。NaCl、AgCl、PbCl2…などがある。AgCl、PbCl2を除いて、全て水に溶けやすい。

AgClは光で分解される。
2AgCl → 2Ag + Cl2
またAgClはアンモニア水と錯イオンを形成して溶ける(下動画)。
AgCl + 2NH3 → [Ag(NH3)2]+ + Cl–
PbCl2は熱水に溶ける。これはPbCl2が溶解度積が大きいためである。

http://lulelaboratory.blogspot.jp/
硫酸塩
金属を硫酸に溶かした際に生じる塩である。CaSO4(下画像)、CuSO4、FeSO4…などがある。CaSO4、BaSo4、PbSO4は水に溶けないが、それ以外は水に溶けやすい物質が多い。

CaSO4、BaSo4、PbSO4以外の硫酸塩の沈殿は、塩酸に溶ける。下動画は沈殿ではないkが、CuSO4(aq)とHCl(aq)との反応である。
CuSO4(aq) + 2 HCl(aq) = CuCl2(aq) + H2SO4(aq)
炭酸塩
金属を炭酸に溶かした際に生じる塩である。CaCO3(下画像)、BaCO3…などがある。炭酸塩は水に溶けにくい。

炭酸塩は塩酸に溶ける。これは弱塩基の遊離反応である。
CaCO3+2HCl→CaCl2+H2O+CO2
クロム酸塩
Ag2CrO4(下画像)、PbCrO4、BaCrO4などがある。これらの塩は水に溶けない。

http://www.chemiaanalityczna.cm.umk.pl/

Good Lord, just like a writer, leave their readers HANGING~~ (smile) Well, I hope it goes wonderful for your friend, whatever it may be and I’ll be watching my feed reader for an update. And I hope you are having a beautiful day yoscRelf!ueberca
[…] 水溶性の塩と難溶性の塩 […]