マンガン乾電池(塩化亜鉛乾電池)
起電力1.5Vの電池である。構造は次の通りである。
(-) Zn | ZnCl2 aq, NH4Cl aq | MnO2・C (+)
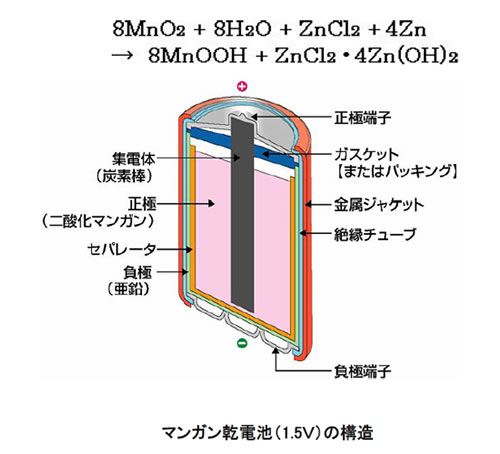
電解質溶液のZnCl2、NH4Clを主成分とした水溶液は、内部に液体が漏れないように合成糊などを使ってペースト状にしてある。
負極(酸化)反応
Zn → Zn2+ + 2e–
正極(還元)反応
MnO2 + H2O + e– → MnO(OH) + OH–
正極の炭素棒は安定の物質であるため電子を受け取らず、周囲のMnO2に電子が与えられる。その結果、NH4+と次のように反応する。
MnO2 + e– + NH4+ → MnO(OH) + NH3
もしくは次のように表される。
2MnO2 + 2e– + 2NH4+ → Mn2O3 + 2NH3 + H2O
Mnの酸化数が+4から+3に減少し還元されている。反応が複雑であるため、記憶する必要はない。また、これらの反応は確実にわかっているわけではない。
また、負極で発生したZn2+は正極のNH3と出会って錯イオン[Zn(NH3)4]2+や[Zn(NH3)2]2+が生じる。錯イオンが形成されることによって、負極のZn2+の濃度が下がり、Znのイオン化がスムーズに進行する。放電によって水が消費されるため、水漏れが少ないのも利点である。
ルクランシェ電池
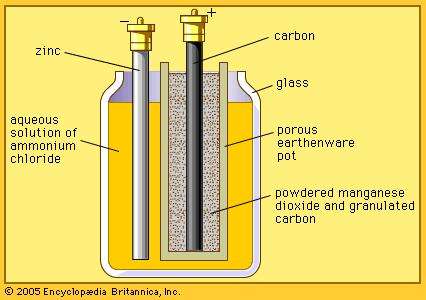
マンガン乾電池のベースとなっている電池である。ルクランシェ電池は、素焼きの円筒内に炭素棒(正極)を立て、その周囲にMnO2とCの粉末を詰めている。また、亜鉛棒(負極)をNH4Claqに浸している。
正極活物質はMnO2、負極活物質はZnである。どちらも固体であるため、溶液の混合や水素発生による分極は起こらない。