五酸化窒素を例に反応速度式を作ってみる
五酸化二窒素を例に考えてみましょう。五酸化二窒素は45℃で温めると分解して次のような反応を示します。
2N2O5 → 2N2O4 + O2
時間ごとにN2O5の濃度を実際に実験して測定すると次の表にようになりました。
| 時間(s) | N2O5のモル濃度 mol/L |
| 0 | 1.40 |
| 400 | 1.10 |
| 800 | 0.87 |
| 1200 | 0.68 |
| 1600 | 0.53 |
| 2000 | 0.42 |
ここから反応速度(N2O5の分解速度)を求めてみましょう。反応速度はN2O5の減少量÷反応時間で求めることができます。
| 時間(s) | N2O5のモル濃度 mol/L | 反応速度(mol/l・s) |
| 0 | 1.40 | |
| 400 | 1.10 | 0~400秒:7.50×10-4 |
| 800 | 0.87 | 400~800秒:5.75 ×10-4 |
| 1200 | 0.68 | 800~1200秒:4.75 ×10-4 |
| 1600 | 0.53 | 1200~1600秒:3.75 ×10-4 |
| 2000 | 0.42 | 1600~2000秒: 2.75 ×10-4 |
反応速度とN2O5のモル濃度をグラフにすると次のようになります。
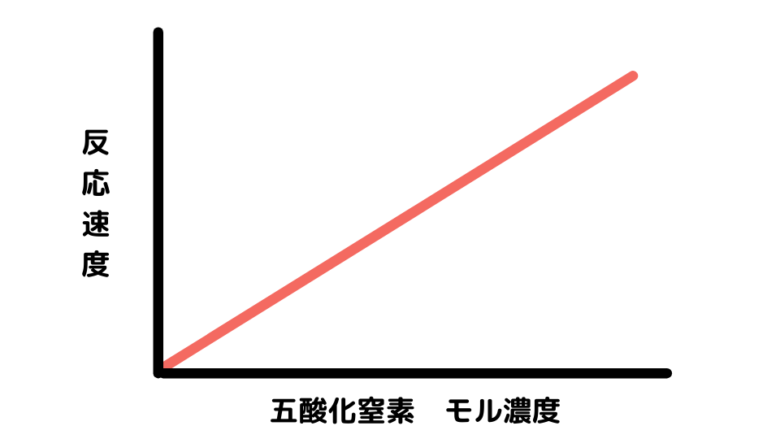
このグラフから、反応速度はN2O5のモル濃度と比例関係にあることがわかります(これは実際に実験することによってしかわかりません)。よって次の式が成り立ちます。
v = k [N2O5]
比例定数kは反応速度定数と呼ばれ、反応の種類と温度によって決まる定数です。この定数は濃度とは無関係です。今回の反応でのkを求めてみましょう。
k = v / [N2O5]
| 時間 | N2O5の平均濃度 mol/l | 反応速度 |
| 0~400秒 | (1.40 – 1.10)÷2 = 1.25 mol/l | 7.50×10-4 〔mol/l・s〕 |
k = 7.50×10-4 ÷ 1.25
= 6.0 ×10-4
よって、この反応では 6.0 ×10-4 が反応速度定数となります。kが決まるといかなる濃度における反応速度もすぐに計算することができるので便利です。

kの値は、時間(区間)ごとに微妙に違ってしまうので、実際には各区間ごとのそれぞれのkを求めて平均化して使います。実験では完璧なデータは得られないのでこのようなことが起こります。