Hの電気陰性度が大きいから
電気陰性度とは分子内の原子が電子を引き寄せる強さの尺度です。
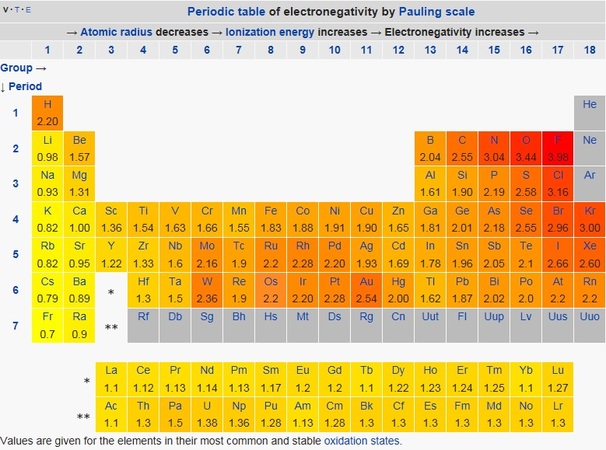
Hの電気陰性度は2.2と大きめです。そのため、HClの結合では電子はClに完全には取られずに共有結合を形成します。
しかし、Clの電気陰性度は3.16で圧倒的にHよりも高いため、電子はCl側に引き寄せられており、Hはプラスに帯電しています。そのため、HClは極性分子になります。

Hがプラスに帯電しているから、水溶液中では水和されてH+が電離しやすいよ。だけど、HClは共有結合で結ばれているよ。
NaClのように電気陰性度の差が大きすぎると電子が完全にClに偏ってしまいイオン結合(Na+とCl-の結合)となります。Hは電子を引く力がそこまで弱くないということですね。
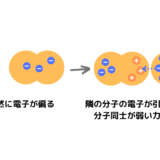
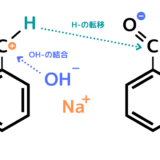
なぜHだけ電気陰性度が高かったり第一イオン化エネルギーが大きいのですか?