#1ではN2O5の分解速度についての反応式を見ていきました。続いて別の視点で反応速度式を見ていきましょう。たとえば、次のような化学反応があったとしましょう。
A + B → C
この反応を実際に実験してみると、Cの開始10秒間での生成速度はAとBの濃度によって変化しました。
| Aのモル濃度 | Bのモル濃度 | 開始10秒間でのCの生成速度(mol/l・s) |
| 0.1 mol/L | 0.1mol/L | 1.0×10-3 |
| 0.2mol/L | 0.1mol/L | 2.0×10-3 |
| 0.1mol/L | 0.2mol/L | 2.0×10-3 |
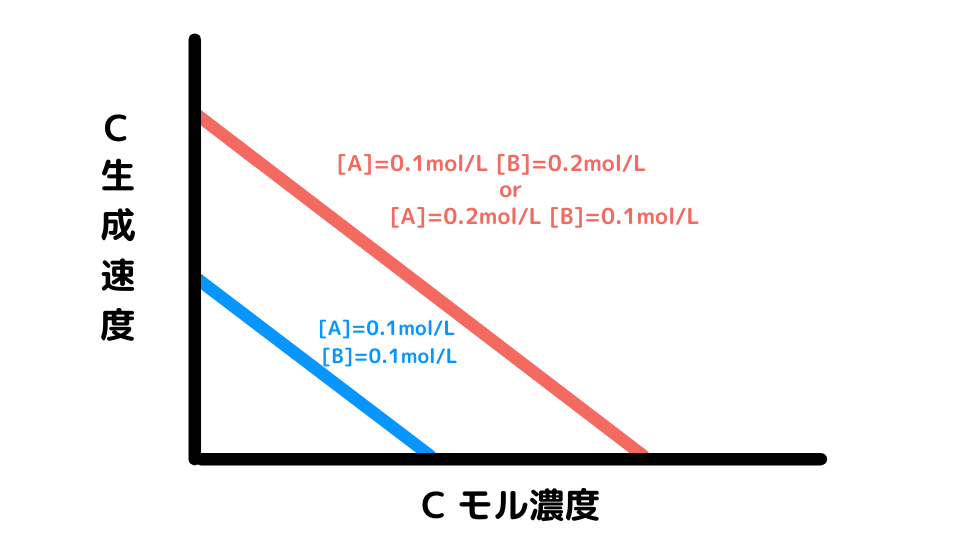
反応の全体像をグラフにすると下のようになりました。AとBの濃度が十分にある反応始めはCの生成速度が高く、Cの濃度が多くなると(AとBの濃度が低下すると)生成速度が低くなります。
今までは、Cの生成速度は下の式のようなCの濃度変化で求めていたと思います。
v = Δ[C] / Δt

この式ではAやBの濃度は関係ないね
しかし、グラフの結果からCの生成速度はAやBのモル濃度によって左右されることがわかります。
また表の数値から、AまたはBの片方が2倍になればCの生成速度も2倍になるため、AとBの濃度とCの生成速度は単純な比例関係にあることがわかります。よって次の式が成り立ちます。
v = k[A][B]

Cの生成速度だけど、AやBの濃度が関わっているから、AとBの濃度で式を作ることができるんだね。
kは比例定数で実験で求められる数値です。温度によって変化します。Cの生成速度なのですがAやBの濃度によって規定されるということがポイントです。