Contents
ハロゲンの性質
ハロゲン(17族)の元素、F、Cl、Br、I、Atは次の性質を持つ元素である。以下のような性質を持っている。
①二原子分子の構造を持つ単体は有毒である。
ハロゲンの単体は全て二原子分子である。原子番号が大きくなるほど波長が長い光を吸収する。そのため、原子番号が小さい方から大きい方へ、色は黄色から紫色へと深くなっていく。
②原子番号が大きいものほど融点が・沸点が高い。
分子間力によって分子結晶を形成するため、原子の大きさが大きいほど、分子間力も大きくなり、融点・沸点も高くなる。

③酸化作用を示す。
ハロゲンは相手から電子を奪う力が非常に強く、陰イオンになりやすい。電子殻の空きが1つであるため、電子を引き寄せて安定しようとする力が強いと考えてよい。
酸化力は原子番号が小さいほど大きい。これは、原子番号が小さいほど電子殻が原子核のより近くにあり、陽子(+)からの引力が強いためである。
フッ素 F2
淡黄色、刺激臭の気体で有毒である。反応性が極めて高く、冷暗所で水素と爆発的に反応する。また、水と反応としてフッ化水素HFと酸素を生成する。フッ化水素はガラスを侵食する際に利用される。
F2とH2の反応
塩素 Cl2
黄緑色、刺激臭の気体で有毒である。水に少し溶けて、次亜塩素酸HClOを生じる。次亜塩素酸は酸化作用が強く、殺菌や漂白剤として用いられる。また、ヨウ化カリウムデンプン紙を青変させる。
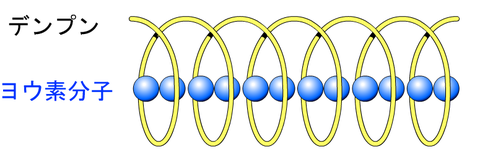
ヨウ化カリウムデンプン紙とは
ヨウ化カリウムデンプン紙とは、酸化剤の有無の検証に使われる試験紙である。酸化剤(電子をもぎ取る物質)に出会うと、2I- →I2+2e–の反応が起こり、その後、I2がヨウ素デンプン反応を起こして青色に変化する。

臭素 Br2
赤褐色の重い液体で有毒である。赤褐色、刺激臭の蒸気を生じる。
ヨウ素 I2
黒紫色で光沢のある結晶である。昇華し(液体にならずに固体から直接気体になる)、紫色の蒸気を生成する。
ヨウ化カリウム水溶液にI3-として溶け、ヨウ素ヨウ化カリウム水溶液(ヨウ素液)となる。通常は水に溶けにくい。また、デンプンと反応し、ヨウ素デンプン反応を起こして紫色になる。



I had no idea how to approach this befroe-now I’m locked and loaded.