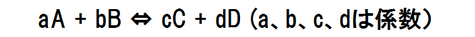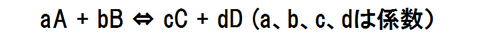Contents
圧平衡定数Kp
下の化学反応のような平衡状態では平衡定数Kと圧平衡定数Kpの関係式が成り立つことが知られている。
![]()
圧平衡定数Kpとは、気体反応における各成分気体の分圧を、PA、PB、PC、PDとした時に、一定温度で求められる定数のことである。
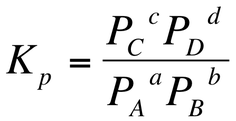
- PA、PB、PC、PDにはそれぞれの気体の分圧が入る。
- a、b、c、dは化学反応式の係数が入る。
気体反応の場合には、濃度よりも圧力の方が測定しやすいため、Kpが使われることが多い。
圧平衡定数の式の求め方
平衡定数を圧平衡定数に変換するためには、気体の状態方程式(PV = nRT)を使う。物質量n ÷ 体積V = モル濃度であるから、式を変換すると次のようになる。
P = n/V × RT
n/V = P/RT
これをそれぞれの気体の分圧ごとに代入していく。例えば、[A]は、PA/RTとなる。RTは定数(温度は一定)であるためまとめると、次のような式になる。
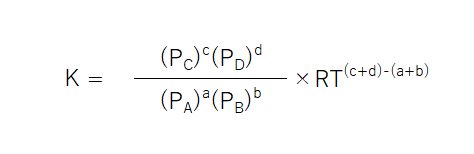
RT(c+d)-(a+d)は定数であるため、省略することができる。
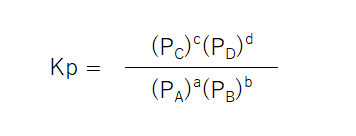
つまり、Kpとは、平衡定数K ÷ RT(c+d)-(a+d)であると言える。RTは定数であるため、Kpも定数となるのである。
例題
N2O4は放置しておくと、可逆反応が起こりNO2へと解離する。その反応は、下の化学反応式で示される。
N2O4 ⇔ 2NO2
N2O4をある容器に入れて100℃に保っているとNO2へと解離が起こり、平衡状態に達した。平衡状態における圧力(全圧)を1.0×105Pa、100℃における圧平衡定数Kpを2.0×105Paとした時、N2O4の解離度αを求めよ。
解き方
反応前のN2O4の物質量をnとし、解離度をαとする。
平衡時のN2O4の物質量は、はじめの物質量nに解離していない割合(1-a)を掛けることによって求まるので、n(1-α) molとなる。
平衡時のNO2の物質量は、N2O4が1molに対してNO2は2mol生成されるので、2nα molとなる。
各気体の分圧は全圧にモル分率を掛けたものに等しい。全体の気体の物質量は、n(1-α) + 2nα = n + nα = n(1+α)である。よって、各気体の分圧は次の式で求まる。

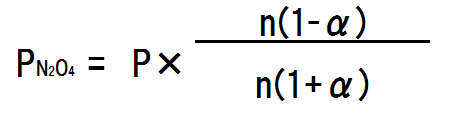
圧平衡定数の式は次のように立てられる。
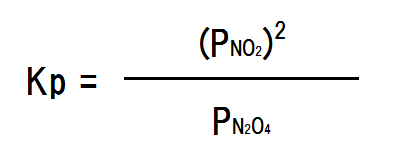
それぞれの分圧の値を当てはめていくと、
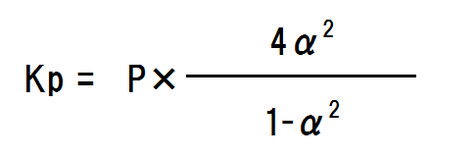
α=の形に変換すると、
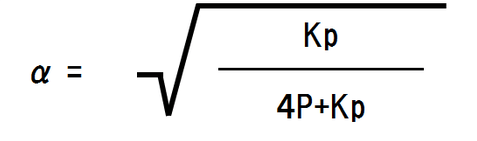
全圧は問題文より1.0×105Pa、圧平衡定数Kpは問題文より2.0×105Paなので、それぞれ代入し、関数電卓で計算する。
X = 0.58