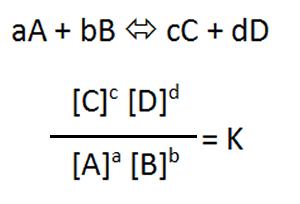平衡定数の計算では素反応に分けて考えるから
反応速度式の次数は化学反応式の係数には、素反応の場合を除いて一致しません。素反応とは中間反応を挟まない最も単純な反応です。五酸化窒素の分解反応は化学反応式では次のようにかけますが…
2N2O5 → 2N2O4 + O2
実際の反応は次のような段階を踏みます。
N2O5→N2O3+O2…(i)
N2O3→NO+NO2…(ii)
N2O5+NO→3NO2…(iii)
4NO2→2N2O4…(iv)
特に(i)の分解反応が遅いため、反応速度は(i)に支配されており、反応速度式は次のように表されます。
v = k[N2O5]

反応速度式では次数が化学反応式の係数と一致していないね。
一方、平衡定数を求める場合には、この素反応全ての反応速度式を出して計算します。
N2O5→N2O3+O2…(i) ⇒ k1[N2O5] = k1′[N2O3][O2] …①
N2O3→NO+NO2…(ii) ⇒ k2[N2O3] = k2′[NO][NO2] …②
N2O5+NO→3NO2…(iii) ⇒ k3[N2O5] [NO] = k3′[NO2]3 …③
4NO2→2N2O4…(iv) ⇒ k4[NO2]4 = k4′[N2O4]2 …④
⓶と③の左辺右辺同士を掛けます。
k2[N2O3] × k3[N2O5] [NO] = k2′[NO][NO2] × k3′[NO2]3
k2k3[N2O3][N2O5] / k2′k3′ = [NO2]4 …⑤
⑤を④に代入します。
k4k2k3[N2O3][N2O5] / k2′k3′ = k4′[N2O4]2
[N2O3][N2O5] / [N2O4]2 = k2’k3’k4′ / k2k3k4 …⑥
①を⑥に代入します。
k1[N2O5] = k1′[N2O3][O2] これを変形して…
[N2O3] = k1[N2O5] / k1′[O2] これを⑥に代入
…
k1[N2O5] [N2O5] / k1′[O2][N2O4]2 = k2’k3’k4′ / k2k3k4
[N2O5]2/ [O2][N2O4]2 = k1′k2’k3’k4′ / k1k2k3k4
平衡定数の式が完成しました。反応速度式とは違い、係数が次数になりましたね。
[N2O5]2 / [O2][N2O4]2 = k1′k2’k3’k4′ / k1k2k3k4 = K

平衡定数の計算では、複雑な反応でも素反応ごとに分けてしまうから係数=次数になるんだね。