銀アセチリドとは?
銀アセチリドAg2C2はアセチレンC2H2と銀イオンAg+を反応させて得られる物質です。

乾燥させた銀アセチリドは非常に高い爆発性を持っています。下の動画では少量の銀アセチリドが爆発する様子が見られます。
なぜ銀アセチリドができるの?
アセチレンと銀イオンが反応する仕組みを見ていきましょう。アセチレンは下のような構造を持った分子です。
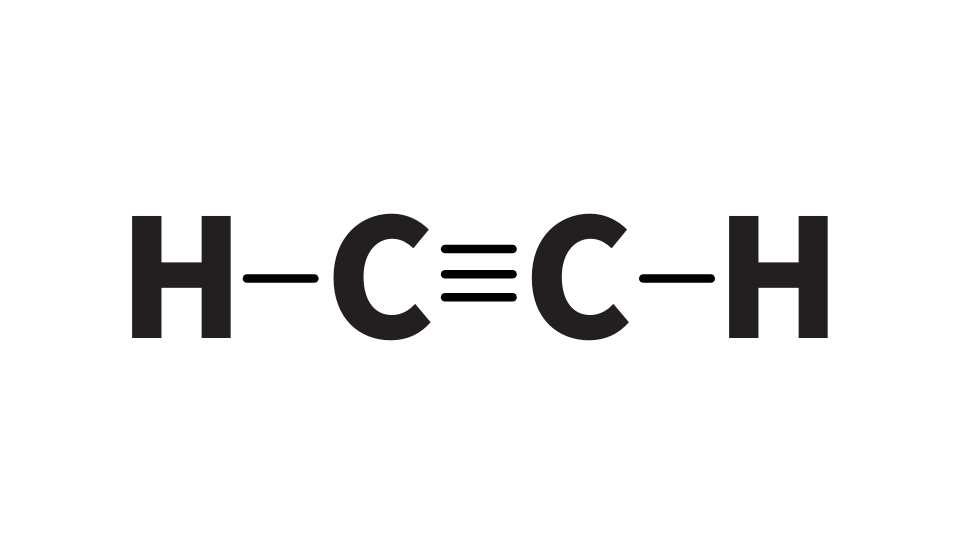
アセチレンの水素原子は弱い酸としての性質を持ち、H+として放出されています。

すると、そこに銀イオンがイオン結合し、銀アセチリドとなります。銀アセチリドは不溶性なので沈殿します。

アセチレンの電離度は非常に弱いですが、–C三C– が銀アセチリドとなって消費されていくため、アセチレンはどんどん電離します。その結果、銀アセチリドが生成される反応が進みます。
アセチレンは弱い酸としての性質を持ちますが、水よりも電離度が低いため酸性は示しません。
なぜ銀アセチリドは沈殿するの?
銀アセチリドに限らず、銀の化合物には沈殿するものが多いです。これは、銀の電気陰性度が高めなことが関係しています。
銀の電気陰性度は1.9であり、金属元素の中では高めです。そのため、よほど電気陰性度が高い原子と結合しないとイオン結合性がはっきりと現れず、水に溶けにくくなってしまいます。
例えば、電気陰性度4.0のFとの化合物AgFは水に溶けます。これは、電気陰性度の差が大きく、イオン結合性がはっきりとするためです。しかし、電気陰性度3.0のClとの化合物AgClは水と溶けません。

銀の化合物はよほど電気陰性度が高い原子との結合でなければ溶けないのです。銀アセチリドAgC三CAgもやはり、そこまでイオン結合性がはっきりしないため水には溶けません。
銀の化合物の多くは水に溶けにくいですが、硝酸銀AgNO3、フッ化銀AgF、過塩素酸銀AgClO4 は水に溶けやすいです。
アルキン(三重結合)の検出に使われる
この反応はアセチレンだけではなく、他のアルキンでも起こります。プロピンは下のような構造をしていますが、やはり、H+ (下画像左端)が電離してAg+ が結合し沈殿が生じます。
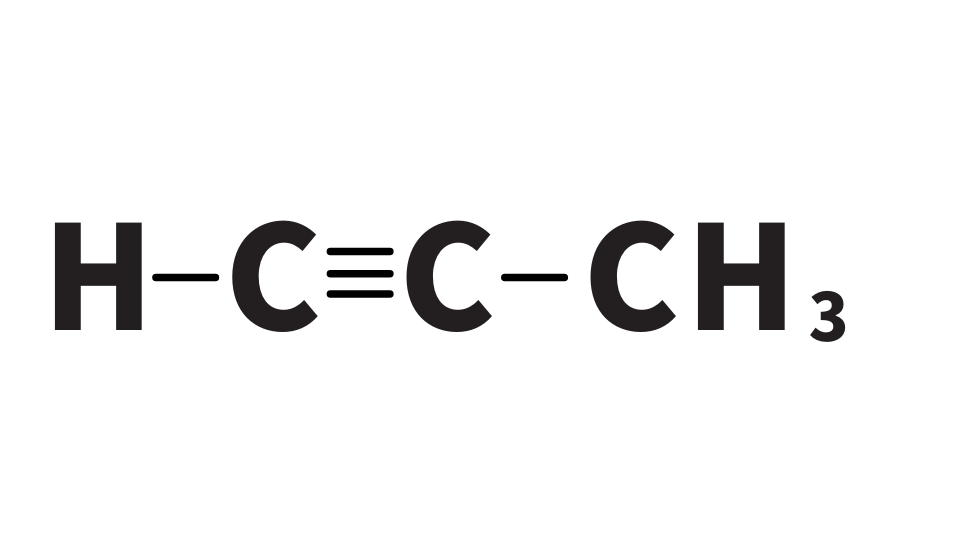
銀イオンと反応しないアルキンもある
しかし、全てのアルキンでこの反応が起こるのではありません。2-ブチンなど三重結合が中央にある場合には、H+が電離しないため、この反応は起こりません。三重結合が末端にあることが反応の条件です。
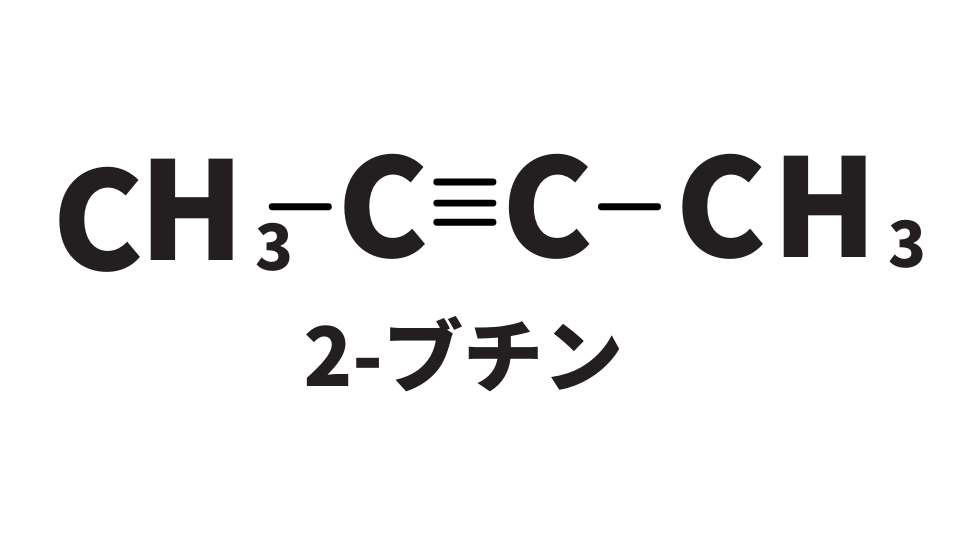
アセチレンのC-H結合はsp混成軌道でできています。球形のs軌道(下画像緑部分)は原子核近くまで軌道が入り込んでおり、原子核からの引力の影響を受けやすくなっています。

その結果、C-H結合の共有電子対はC側に引きつけられ、極性が大きくなり、H+が放出されやすくなると考えられています。
アセチレンは無極性分子に分類されますが、上記のような性質を持つことから、水に対してほぼ等体積溶解します。