電子配置を見ながら考えよう
銅Cuの電子配置を書いてみましょう。高校化学で扱うK、L、M、N殻をさらに細かく書くと次のようになります。↓や↑の矢印は電子を表しています。
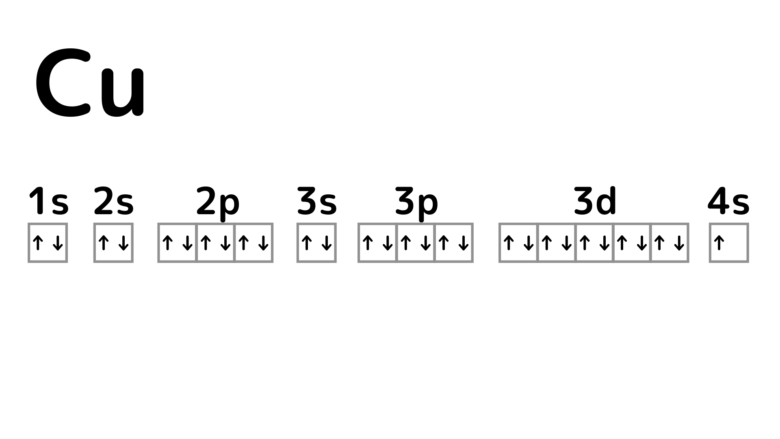
銅がイオンになる際には、初めに一番外側の電子1個が放出されます。するとCu+のイオンになります。
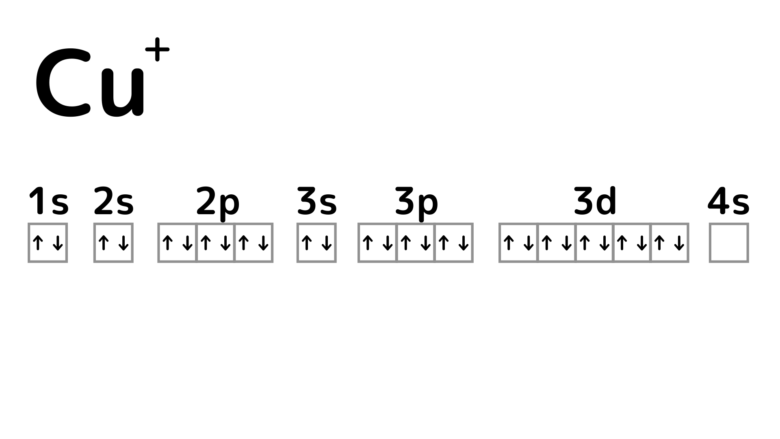
3dは閉殻状態なので安定!しているかのように思えるのですが、3d軌道から電子が1つ放出されてCu2+が形成されます。実はCu2+はCu+よりも安定したイオンです。
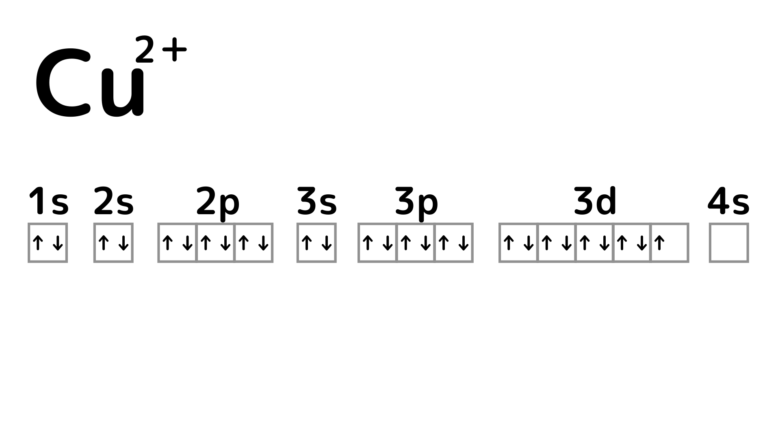

確かによく目にするのはCu2+のイオン化合物だね。
3d軌道は原子核に近く軌道が小さいので10個の3d電子で閉殻になると、電子間反発が生まれます。そのため、完全に閉殻しているよりも、電子が1つ無くなって余裕がある方が安定すると考えられています。

電子軌道だけ見ればCu+だけが生じそうだけど、電子間反発という現象によってCu2+のイオンが生じるんだね。