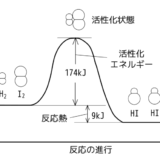
アンモニアの生成反応は発熱反応ですが逆反応が起こる可逆反応です。
N2 + 3H2 ⇔ 2NH3 ( +92kJ)
エネルギーの観点からみると、アンモニアが生成された方がエネルギーが低い状態になるため、右へと反応が進みます。
N2 + 3H2 → 2NH3
一方エントロピーの観点から見ると、左辺では合計4molの分子、右辺では2molの分子なので、右辺の方が乱雑さが減少しています。
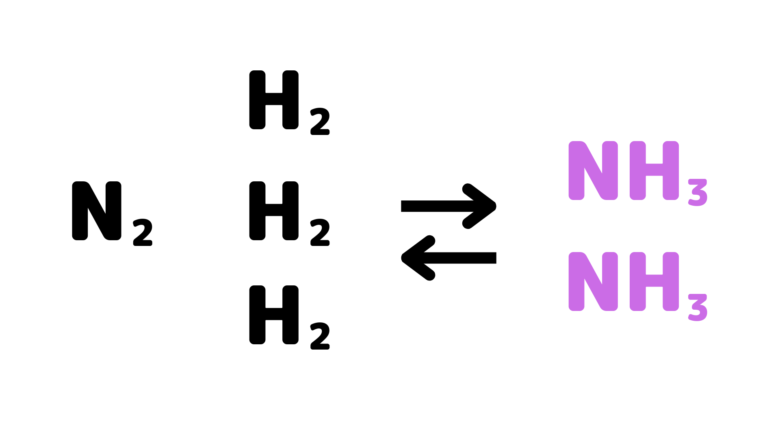
そのため、乱雑さが増加する左辺へ向けて(NH3の分解反応)の反応も起こります。
2NH3 → N2 + 3H2
その結果、可逆反応が起こり、いずれ平衡に達します。

エネルギー的に安定かに加えて、エントロピーが増大するかどうかも反応の方向を決定する要因となっているんだね。