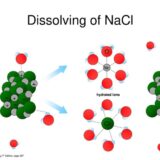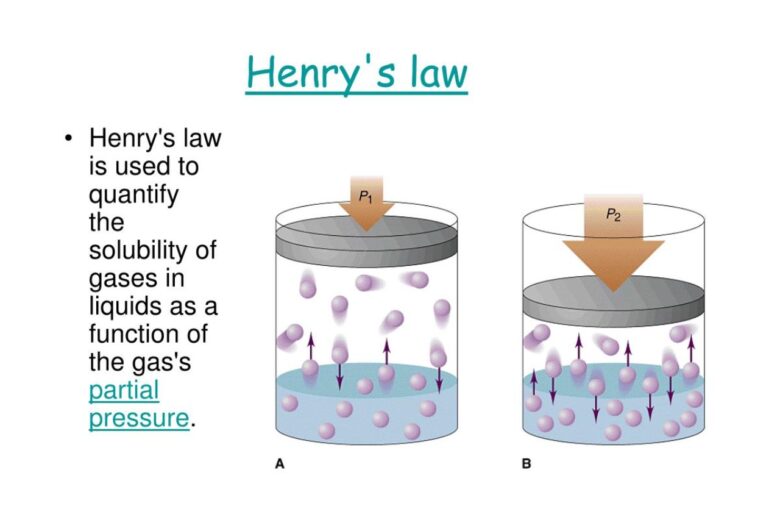
ヘンリーの法則とは「溶解度が小さい気体の場合、一定温度で、一定量の溶媒に溶ける気体の物質量は、その気体の圧力に比例する」というものです。つまり、圧力を高めれば気体はよく溶けるという話をしています。
ヘンリーの法則はH2、N2、O2のような溶解度が小さい気体にのみ成り立つ法則です。塩酸やアンモニアでは成り立ちません。そもそも、塩酸やアンモニアは水と溶解しているというよりも、水と反応していると言って良い状態です。
HCl + H2O → Cl– + H3O+
NH3 + H2O → NH4+ + OH–
この場合、圧力に加えて、この反応の平衡も考慮に入れないとならないため、ヘンリーの法則には従わなくなります。

ヘンリーの法則は電離したりしない気体限定なんだね