ベンゼンと塩素の置換反応には触媒が必要
ベンゼンに塩化鉄(Ⅲ)FeCl3を加えて塩素Cl2ガスを通じると、クロロベンゼンが生成されます。これを置換反応と呼びます。
C6H6 + Cl2 → C6H5Cl + HCl
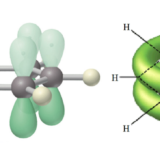
ベンゼンは置換反応を行いますが、ベンゼン環はπ電子雲(下画像右)で包まれているため、陰イオンは近づくことはできません。ベンゼンの置換反応は陽イオンが近づくことによって起こります。

陽イオンしか近づけないから、触媒を用いて塩素を陽イオン化しなきゃいけない。
ベンゼンと塩素の反応では、まずFeCl3がCl-Cl結合を分極させて[FeCl4]–という錯イオンになり、Cl+(クロロニウムイオン)が作られます。
FeCl3 + Cl2 → [FeCl4]– + Cl+
Cl+はベンゼン環のπ電子を攻撃して中間体を作ります。ベンゼン環の二重結合の電子がCl+に供給される代わりに、ベンゼン環のCが電子不足になります。

続いて、[FeCl4]– はH+を引き抜きFeCl3とHClが生成されます。Hは電子をベンゼン環に供給してからH+となるため、ベンゼン環が復活します。こうしてクロロベンゼンが生成されます。


塩化鉄だけじゃなく鉄粉でも触媒として機能するよ。