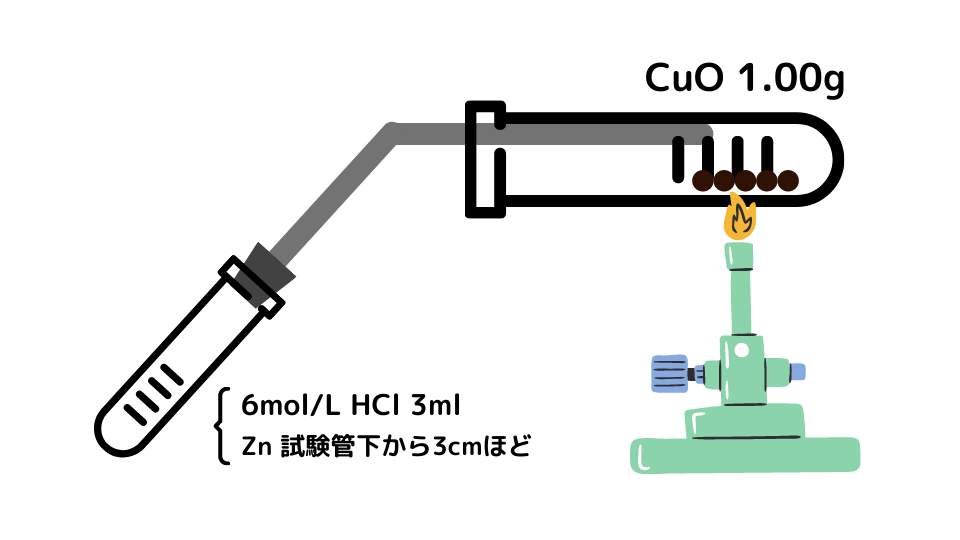
- 事前に銅粉末を強熱して、全て酸化銅にしておく。
- 試験管Aに酸化銅(Ⅱ)1.00gを入れて質量(W1)を測定する。
- 酸化銅を均一に広げ、ガスバーナーで強熱する。
- 試験管Bに亜鉛を底から3cmくらいまで入れ、6mol/L HClを試験管の半分くらいまで加え、発生した水素を試験管Aに送る。
- 水も完全に蒸発させ、全体の反応が終わったら冷やし、その後試験管Aの質量(W2)を測定する。
- W1 – W2をして、減少したO原子の質量、残ったCuの質量を計算する。

水素はCuOの酸素Oと結合して水になるよ。
酸素の原子量が16だとわかっている前提で、酸化銅の原子量を求めましょう。
例えば、減少した質量が0.20g(つまり0.80gのCuが残った)としましょう。減少した0.20gのO原子の物質量は次の比例式で求められます。
1mol:16g = Xmol:0.20g
X = 0.0125mol
酸化銅(Ⅱ)CuOは銅原子と酸素原子が1:1で結合しているので、Oが 0.0125mol あったということは、Cuも 0.0125mol あるということです。つまり、0.80gはCu 0.0125molの質量なので、Cuの1molあたりの質量は…
1mol:Xg = 0.0125mol:0.80g
X = 64
1molあたり64gなので、Cuの原子量は64だということがわかります。

実際にやってみるとかなり誤差があるよ…。考える練習の1つとしてやってみるのはいいかもね。