平衡定数とは
平衡定数Kとは、化学反応の平衡状態を、物質の存在比で表したものである。aA + bB ⇔ cC + dDが成り立つ場合、平衡定数Kは下の式で求められる([A]は物質Aのモル濃度を示す)。温度一定の平衡状態においてKは常に一定の値を示す。

濃度平衡定数Kc
ある平衡状態において、濃度において成立する関係である。濃度平衡定数とも、単に平衡定数とも呼ぶ。下の式はH2 + I2 ⇔ 2HIの平衡定数を示している。

圧平衡定数Kp
濃度平衡定数を、気体の状態方程式を用いて変換した式である。Pには、各気体の分圧の値が入る。

水のイオン積
水溶液中において、水が水素イオンと水酸化物イオンに電離する反応の平衡である。[H2O]は水素イオン・水酸化物イオンに比べて大きいため、定数と見なす。

弱酸・弱塩基の電離定数
弱酸・弱塩基の電離によって生じたイオンと、電離していない弱酸・弱塩基との間で成立する平衡である。電離度をαとすると、電離定数から水素イオン濃度を求めることができる。下の式はアンモニアの電離平衡を示しているが、[H2O]は殆ど変化しないために式に含めない。

加水分解定数
弱酸・弱塩基のイオンが水と反応することによって生じる酸・塩基との間で成立する平衡である。加水分解定数は水のイオン積 / 弱酸(弱塩基)の電離定数で求めることができる。また、水素イオン濃度、水酸化物イオン濃度も加水分解定数から求めることができる。

上記の式の分母分子に[H+]を掛けると次のようになる。

オレンジ色の部分は酸の電離定数Kaの逆数である。また、青色の部分は水のイオン積Kwである。よって、次のように変換できる。

まとめ
様々な平衡定数があるが、基本的に質量作用保存の法則の応用であるため難しく考える必要はない。
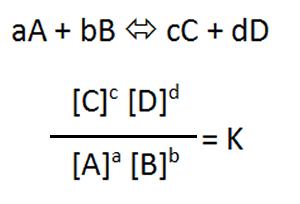
混乱しやすいのは、その反応系で殆ど濃度が変化しない物質(例えば加水分解に使われる水)は定数とみなしたり、電離度αなどは1よりも非常に小さい数として1 – α = 1とみなす点にある。
なぜ1 – α(電離度) = 1なのか
実際に1 – α = 1とせずに計算してみるとどれだけの差が生じるのだろうか。例えば、0.030(mol/L)の酢酸の電離度を0.030として電離定数を求めてみよう。
Ka = (cα)2 / c(1-α) = 2.78 × 10-5 = 2.8 × 10-5
Ka = cα2 = 2.7 × 10-5
下一桁が変化したが、これを極僅かな差と見るか、大きな差と見るかが重要である。通常の化学の量的関係ならば「大きさ差」として処理するだろうが、平衡においては極僅かな差として処理する。そのため、1 – α = 1と見なして良いのである。
弱酸・弱塩基の電離度は、濃度が低くなればなるほど増加することが知られている。電離度が大きくなりすぎると、1 – α = 1とは見なせなくなり、計算式に組み込まなければならない。

