融ける分子と凍る分子の数の差が生じるから
例えば水は0℃で凝固しますが、0℃の状態の時には融ける水分子と凍る水分子の量が等しく平衡状態にあります。見た目は凍っていますが、「融ける・凍る」を繰り返しています。
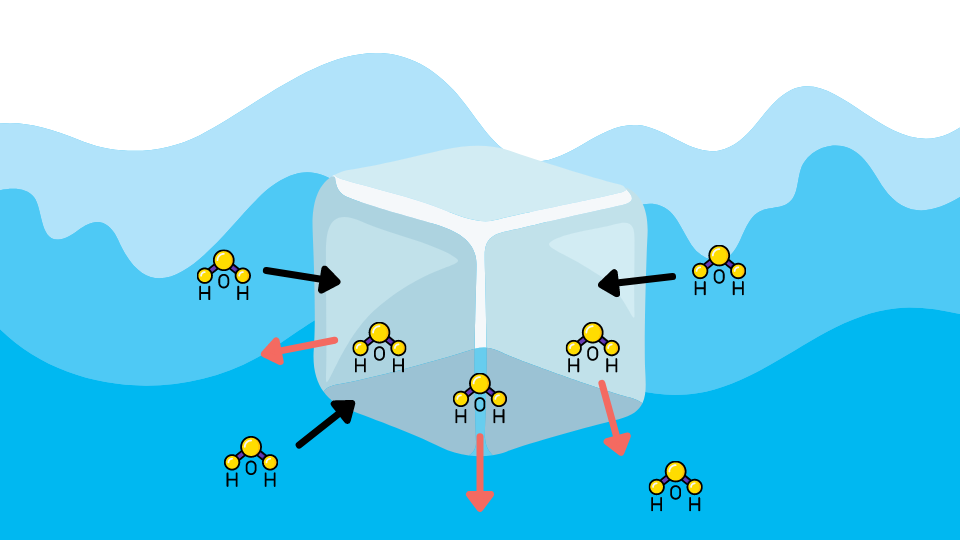
溶液では、溶質の分子が邪魔をして氷に衝突する水分子の量が少なくなります。その結果、凍る分子よりも融ける分子の方が多くなり、凍りません。溶液を凍らすためには、さらに水分子の運動を抑える必要があるため、温度を下げなければなりません。つまり、凝固点が低下します。
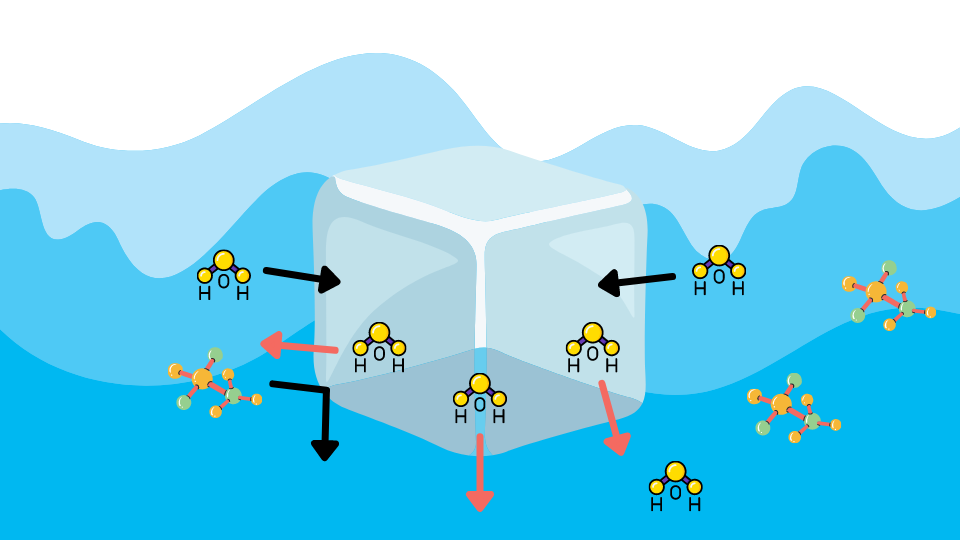
例えば水は0℃で凝固しますが、0℃の状態の時には融ける水分子と凍る水分子の量が等しく平衡状態にあります。見た目は凍っていますが、「融ける・凍る」を繰り返しています。

溶液では、溶質の分子が邪魔をして氷に衝突する水分子の量が少なくなります。その結果、凍る分子よりも融ける分子の方が多くなり、凍りません。溶液を凍らすためには、さらに水分子の運動を抑える必要があるため、温度を下げなければなりません。つまり、凝固点が低下します。
