例えば[H+]=1.0×10mol/LではpH=-1になります。また、[OH–]=1.0×10mol/LではpH=15となります。しかし、普通は水素イオン濃度pHはpH0~14の間の希薄な溶液しか扱いません。
pHが0以下の濃度の酸、pHが14以上の塩基は普通はモル濃度で表します。
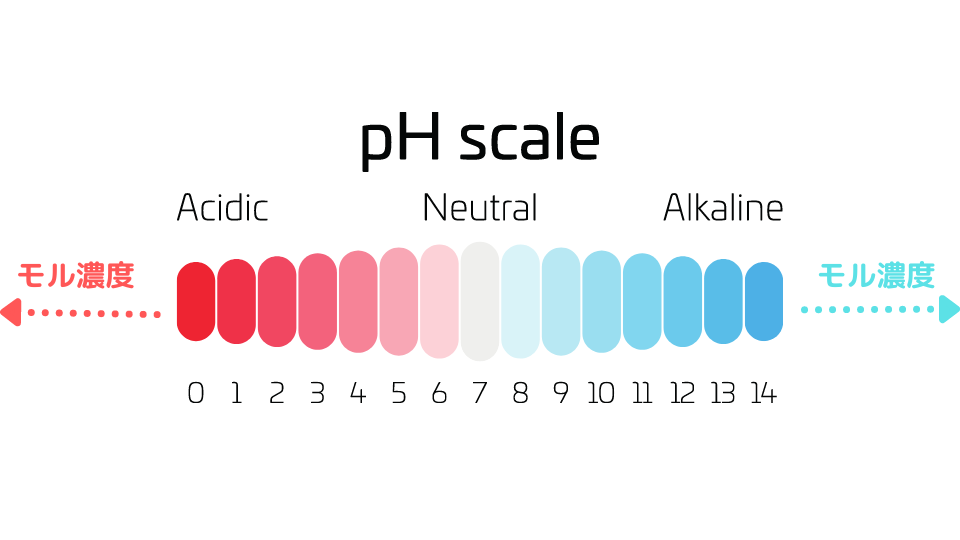

pHはあくまで希薄な溶液のための基準なんだね。
例えば[H+]=1.0×10mol/LではpH=-1になります。また、[OH–]=1.0×10mol/LではpH=15となります。しかし、普通は水素イオン濃度pHはpH0~14の間の希薄な溶液しか扱いません。
pHが0以下の濃度の酸、pHが14以上の塩基は普通はモル濃度で表します。


pHはあくまで希薄な溶液のための基準なんだね。