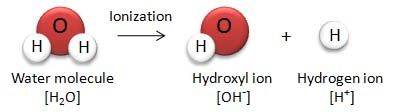
水の電離
水は極わずかにH+とOH-に電離している。
http://www.aquahealthproducts.com/
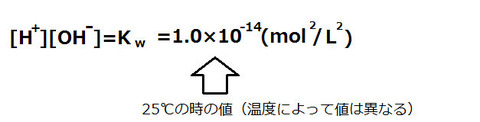
水のイオン積
H+の濃度と、OH-の濃度を掛けたものは1.0×10-14(mol/L)2であり、温度が一定ならばこの値は変化しない。
なぜ水のイオン積はどのような水溶液でも一定なのか
水のイオン積の値はどのような水溶液(酸や塩基)であっても変わらない。例えば、水に酸を加えると、右辺のH+が増加するので、ルシャトリエの原理により反応系は変化を減らす方向に進むので、下の反応では左向きに傾く。

平衡定数は、温度によってのみ変化する定数であるため、H+の濃度が大きくなっても、反応が左向きに傾くとH+とOH-の濃度は減少する。結果として、分子も分母も変化し、Kの値は一定となる。これを質量作用の法則と呼ぶ。平衡定数は濃度や圧力では変化せず、温度によってのみ変化するということがとても重要。

水においては殆ど電離しないため(1000万分子中1個)、H2O濃度はほぼ一定(定数)であると考えて良い。式から除外(左辺に移動)すると、定数である水のイオン積Kwが得られる。
![]()

Stands back from the keyboard in amtameenz! Thanks!