水素とは
水素は宇宙に最も多く存在する元素である。宇宙での水素の存在比は75%であり、宇宙が作られた時に初めに水素ができた。その後、核融合反応によってHe~Feまでの元素ができ、さらに超新星の爆発によってFeより原子番号が大きい元素が作られた。
http://hydrogenatomgirikosa.blogspot.com/
地球においては、存在比が0.9%である。これは、地球誕生の際の高温によって、水素が地球外へと流出したためと考えられている。
水素の性質
水素は次の性質を持つ化合物である。
①無色、無臭
②気体として最も軽い
③水に溶けにくい
水素は水に僅かには溶けることができ、水素を僅かに溶解させたものが水素水である。

④燃焼すると爆発する
水素:酸素=2:1の割合で引火させると爆発が起こる。この割合の気体を水素爆鳴気と呼ぶ。
⑤還元作用を示す
還元とは相手の酸素を奪う反応である。
CuO + H2 → Cu + H2O
または、相手に電子を与える反応とも説明できる。
H2 → 2H+ + 2e–
水素の製法
水素を得る方法として、水の電気分解、CとH2Oの反応、金属と酸の反応によって得ることができる。
水の電気分解
水素は水の電気分解によって得られる。
2H2O → 2H2 + O2
CとH2Oの反応
電気分解では製造コストが高いため、赤熱したコークス(C)に水蒸気を吹き付けて、H2を得る方法もある。
C + H2O → CO + H2
このCOとH2の混合ガスを水性ガスと呼ぶ。水性ガスをさらに触媒に通す、COを酸化してCO2とする。
CO + H2O → CO2 + H2
さらに、この混合ガスをアルカリ水溶液に通すと、CO2は酸性酸化物であるためアルカリ水溶液と反応し、H2だけを得ることができる。
金属と酸の反応
イオン化傾向がHよりも高い金属を酸に加えた場合、酸に含まれるH+が金属原子から電子を奪い、H2が発生する。
Zn + 2HCl → ZnCl2 + H2
なお、固体試薬に液体試薬を加えて常温で気体を発生させる際には、キップの装置を用いると便利である。キップの装置では、発生した気体が通る管に栓がついており、栓を閉めると、内部の圧力があがり、液体試薬を押し上げて固体試薬から離れ、反応が止まるようになっている。
水素の用途
水素は酸素と反応して多量の熱を発生させるため、酸水素炎として、金属の溶接などに使用されている。
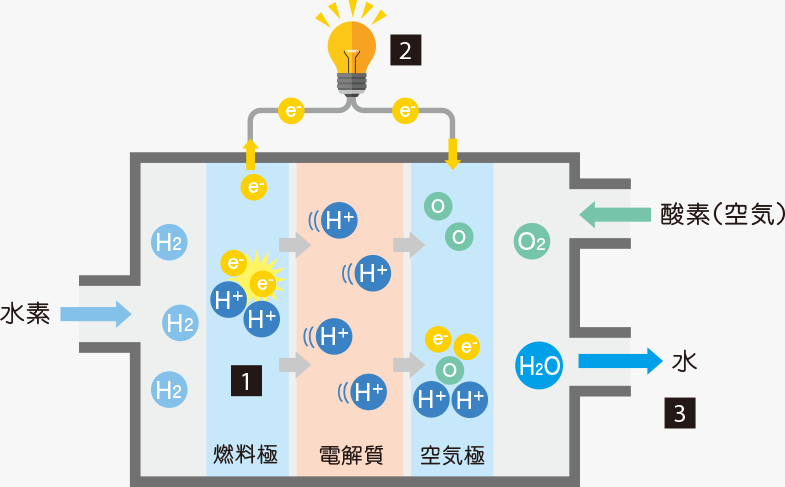
また、アンモニアや塩酸の原料、燃料電池などにも使用されている。