あるA、B、C、Dの気体の反応において、平衡状態では次の式が成り立ちます。
aA + bB ⇔ cC + dD(a,b,c,dは係数)
この時、圧平衡定数Kpと平衡定数Kの間には次の関係式が成立します。この式の求め方を見ていきましょう。
Kp = K × (RT)(c+d)-(a+b)

ぱっとみるとよくわからないけど、気体の状態方程式を使えば簡単に変換できるよ
ある気体Aに注目すると、気体の状態方程式により次の式が得られます。
PAV = nART
(PA=気体Aの圧力、nA=気体Aの物質量)
これを変換すると次の式になります(物質量を体積で割るとモル濃度になります)。
PA = nA / V × RT = 〔A〕RT
(〔A〕= 気体Aのモル濃度)
さらに式を変換すると…
〔A〕= PA / RT
これを平衡定数の式に代入します。同様に他の気体B、C、Dについても代入します。すると次の式が得られます。
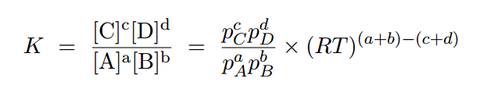
平衡状態時は温度が一定であるのが原則なので、Tは一定値となります。また、Rは気体定数のために一定になります。(a+b)-(c+d)の部分も化学反応式の係数なので一定の数です。つまり、「(RT)(a+b)-(c+d)」は一定値となります。そして、「(RT)(a+b)-(c+d)」を定数としてとっぱらったものが圧平衡定数になります。
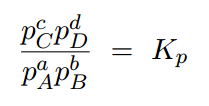
つまり、平衡定数は圧平衡定数に(RT)(a+b)-(c+d)を掛けたものであることがわかります。
K = Kp × (RT)(a+b)-(c+d)
よって…
Kp = K × (RT)(c+d)-(a+b)

平衡定数を求める式にPV=nRTを突っ込むと圧平衡定数に変換できるんだね。
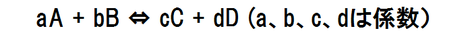

Stay with this guys, you’re heinplg a lot of people.
5個目の式間違ってますよ
あってますよ。
間違ってますよ。〔A〕=РA/RTにしないと一個前の式も破綻しますし、結論も間違った式となって出てきます。
訂正遅くなりすみません!
訂正いたしました。コメントありがとうございました!
くさ