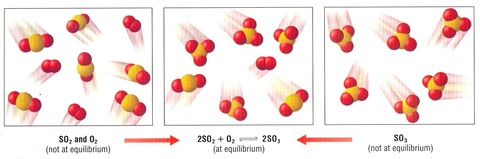
可逆反応
反応物⇔生成物、どちらの方向にも進む反応を可逆反応と呼ぶ。反応物→生成物を正反応、生成物→反応物を逆反応と呼ぶ。
化学平衡
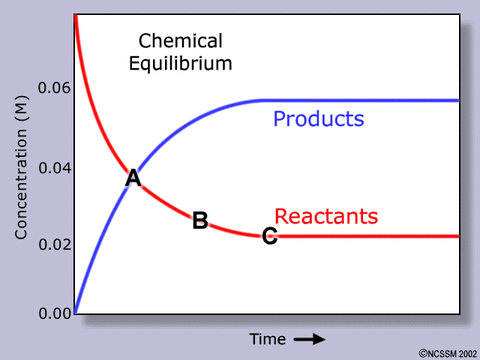
正反応と逆反応の速さが等しくなったとき、見かけ上は反応の進行が停止しているかのように見える。この状態を化学平衡と呼ぶ。反応物と生成物が共存している。
平衡移動
平衡状態は微妙なバランスで保っているため、濃度、圧力、温度を変化させるとバランスが崩れる。結果、変化の影響を和らげる向きに反応が進み、最終的に新しい平衡状態を形成する。これをルシャトリエの原理と呼ぶ。 次の化学式で具体的に考えてみたい。
濃度の変化
NH3を加える:NH3が分解するため←の向きに平衡移動する。
NH3を取り除く:NH3を生成するため→の向きに平衡移動する。
圧力
圧力を加える(体積減少):気体分子が減少するため→の向きに平衡移動する。
圧力を減少させる(体積増加):気体分子が増加するため←の向きに平衡移動する。
温度
加熱する:温度が低下する吸熱反応の←の向きに平衡移動する。
冷却する :温度が上昇する発熱反応の→の向きに平衡移動する。
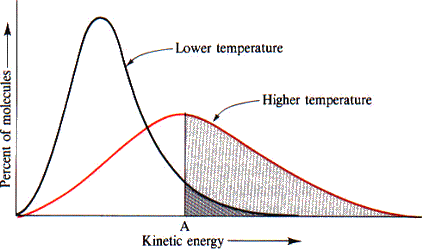
アレニウスの公式が有名ですがあれはいわゆる一つのラプラス変換ではないでしょうか
まぁそうだとしても複素数の意味が分かりませんが(汗