極性溶媒と無極性溶媒
溶液は極性(物質内での電気的偏り)の有無によって分類することができる。極性が液体を極性溶媒と呼ぶ。極性がない液体を無極性溶媒と呼ぶ。
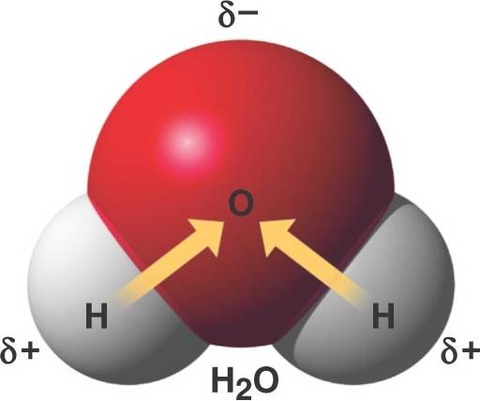
水は代表的な極性溶媒
極性溶媒
水が代表的な例として挙げられる。多くのイオン結合性物質や、極性分子を溶かすことができる。

無極性溶媒
ベンゼン、ヘキサンなどが代表的な例として挙げられる。ヨウ素などの無極性分子を溶かすことができる。
水和
水分子が溶質と静電気的な力や水素結合によって結合することを水和と呼ぶ。「水に溶ける」という現象は言い換えると、水分子に囲まれるということである。
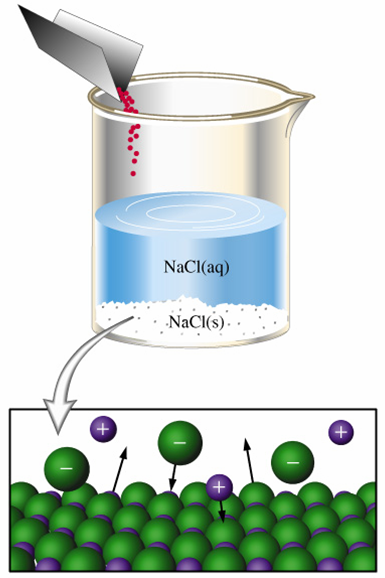
イオン結晶と水和
イオン結晶は水分子が静電気的な力で結合し電離する(溶解する)。 なお、イオン結合が非常に強い物質(フッ化ナトリウムなど)は水分子の力では引き離すことができず、溶かすことはできない。
極性分子と水和
アルコールなどはヒドロキシル基(-OH)の電子に偏りがあり、水分子と水素結合を結ぶことができる。エタノールと水は極めて相性が良く、いくらでも溶かすことができる。
実験で確かめよう
準備
それぞれの薬品を少量準備する。
溶媒:水(極性溶媒)、灯油(無極性溶媒)、メタノール (水よりは弱い極性を持つ溶媒)
溶質:NaCl(イオン結合性物質)、ヨウ素I2(無極性分子)
実験方法
次の組み合わせで溶質が溶媒に溶けるかどうかを確認する。
水+NaCl
灯油+NaCl
メタノール+NaCl
水+ヨウ素
灯油+ヨウ素
メタノール+ヨウ素
水+メタノール
水+油
ヨウ素+メタノール+水
ヨウ素+メタノール+油
結論
極性+無極性は基本的に混ざり合わない。
メタノールの極性は弱いので、NaClを溶かすことはできない。
メタノールは中間的性質を持つので、ヨウ素を水に溶かすための仲介役となる(イソジン)。
メタノールは完全に無極性ではないので、メタノールに溶けたヨウ素は灯油に吸い取られる(抽出)。