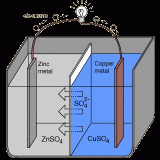
ボルタ電池とは
希硫酸に亜鉛板と銅板を離して浸し導線で繋いだものをボルタ電池と呼ぶ。ボルタが1800年に発明した最初の電池である。
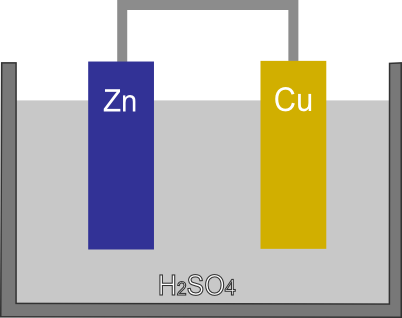
亜鉛は酸に浸すと水素イオンよりもイオン化傾向が高いため亜鉛イオンとなって溶け出す。その結果、電子が亜鉛板に残されることになる(導線でつないでなければH+が受取りH2が発生する)。
一方、銅はイオン化傾向が水素イオンよりも小さいためイオン化は起こらない。そのため、銅板は亜鉛板に比べると電位が高い状態となる。結果、亜鉛板の電極に貯まった電子は、導線を伝わって銅板へと移動する。
銅板に貯まった電子は、最終的に水溶液中の陽イオンに受け取られる。水溶液中には亜鉛イオンと水素イオンが存在するが、亜鉛イオンより水素イオンの方が電子を受取りやすい。そのため、水素イオンが電子を受け取り、H2が発生する。
ボルタ電池の起電力
起電力は電極の種類によって決定される。ZnとCuを電極に使った電池の起電力はどれも約1.1(V)である。しかし、電解質の濃度を変えることによって僅かに起電力が変化することも知られている。
ボルタ電池の分極
ボルタ電池の起電力は1.1Vであるが、放電すると電圧は0.4~0.5Vに低下する。このように極板に生じた何からの物質によって起電力が下がることを電池の分極と呼ぶ。ボルタ電池の分極には以下の理由が考えられる。
銅板で水素が多く発生して電極の表面を覆い、電子の流れを妨げるため。銅板をH2が完全に覆うと銅板は不活性化されて、一種の水素電極のような性質を持つようになる。結果、次のような電池式となる。
Zn | H2SO4aq | H2
ZnとH2の電極では、起電力が0.7Vであり、ボルタ電池よりも低い値である。
分極を防ぐ方法
ボルタ電池ではH2が電極の表面に付着するのが分極の原因となっている。そのため、過酸化水素や二クロム酸カリウムK2Cr2O7などの酸化剤(酸化剤ならば何でも良い)を加え、H2を酸化してH2Oに反応を起こさせれば、分極を防ぐことができる。このように分極を防ぐような酸化剤を分極剤と呼ぶ。
ちなみに二クロム酸カリウムを酸化剤として加えると、当初の起電力1.1Vを軽く超えてしまう(2.1V)。これは、二クロム酸イオンが水素イオンに代って銅板上で直接電子を受け取るような還元反応をすることが原因と考えられている。この積極的な還元反応によって、銅板中の電子は少なくなり、銅板の電位が上昇するのである。