化学反応は①系のエネルギーを小さくする傾向と、②系の乱雑さ(エントロピー)が増大する傾向の2つによって制御されます。
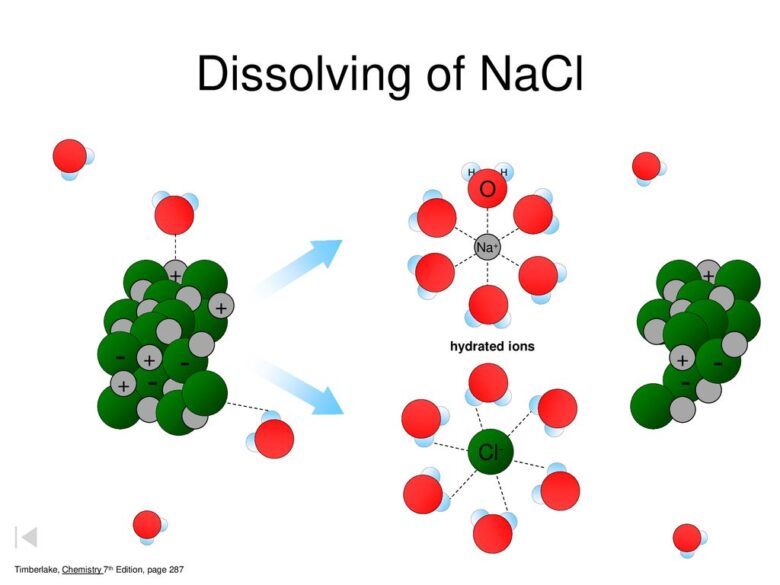
塩化ナトリウムの溶解は下の式に示すように吸熱反応です。つまり、水に溶けるにはエネルギーが必要です。
NaCl(固)+ aq → Na+aq + Cl–aq -3.9kJ
吸熱反応にも拘わらず、この反応は飽和溶液になるまでは右へと進んでいきます。①の傾向に従うと反応は左向きに進みますが、②の傾向に従うと結晶状態よりも水に溶けた状態の方がバラバラなのでエントロピーを増大させる右向きに反応が進みます。
飽和溶液に達する前までは②の傾向の方が強いため、塩の結晶はどんどん水に溶けていきます。最終的に①と②の相反する傾向がちょうどつり合った状態で溶解は止まります(溶解平衡に達します)。

吸熱反応でも溶解が進む理由はエントロピーの増大のためだったんだね。