紀元前400年ごろ、ギリシャのデモクリトスは原子説を唱え、物質は最小単位の原子からできていると主張しました。
1803年ドルトンが原子論を発表し、物質はそれ以上分割できない最小単位「原子」からできていると考えられるようになりました。
しかし、1897年にイギリスのトムソンが原子よりも小さな電子を発見。ブドウパンモデルを考え、電子が散らばっている状態であるとの仮説を立てました。

1911年にイギリスのラザフォードが原子核を発見し、ようやく原子核の構造が明らかになりました。ラザフォードはトムソンの弟子です。ラザフォードは金箔にプラスの電荷を持つα粒子(ヘリウムの原子核)をぶつけ、跳ね返ってくる粒子が2万個に1個の割合で存在したことから、強いプラスの電荷を持つ核「原子核」の存在を提唱しました。
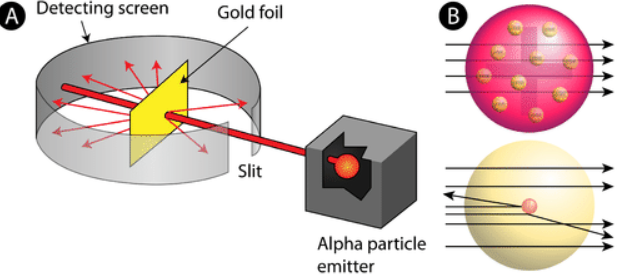

B上段の核がない状態(プラス電荷が全体に散らばっている状態)ではなく、中心に核があることがわかったんだね。
原子は中心に原子核があり、原子核には正の電荷を持つ陽子と電荷を持たない中性子が存在しています。原子核の周囲には負の電荷を持つ電子が存在します。
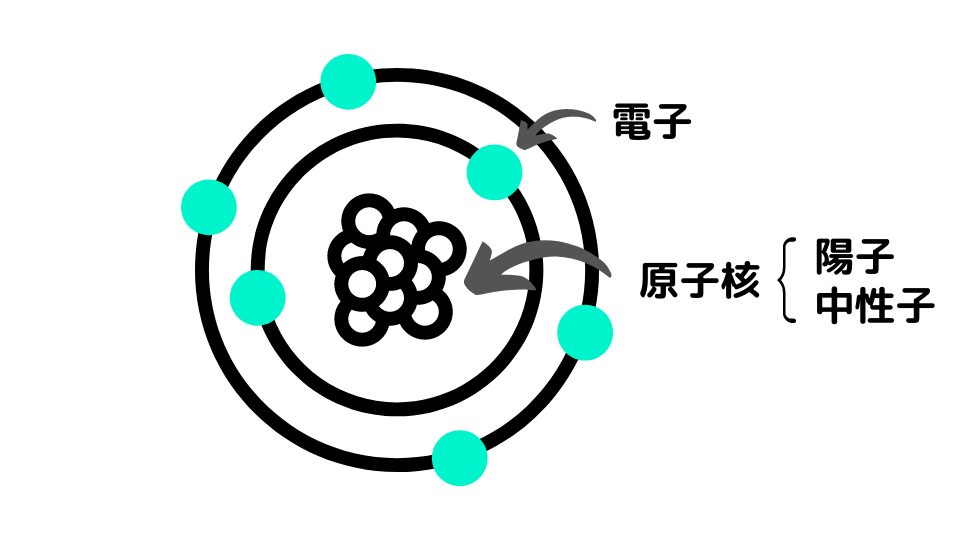
中性子は正電荷同士で反発する陽子同士を繋ぎとめる働きがあります。
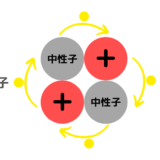 中性子の役割とは?なぜ水素には中性子がないの?
中性子の役割とは?なぜ水素には中性子がないの?
原子の種類は陽子の数によって決定されます。そのため、陽子の数を原子番号と呼びます。原子番号は元素記号の左下に記します。陽子と中性子の数の合計を質量数と呼びます。

途中までは陽子と中性子は1つずつ増えていきますが、大きな元素では中性子の数が陽子よりも格段に多くなります。


大きくなりすぎると原子が不安定になるよ。
電子が入る軌道のことを電子殻(でんしかく)と呼びます。電子殻は内側からK殻、L殻、M殻、N殻…と名前が付けられており、それぞれの殻に入ることができる電子の数は決まっています。
| K殻 | 電子2個まで |
| L殻 | 電子8個まで |
| M殻 | 電子18個まで |
| N殻 | 電子32個まで |
その原子の最も外側の電子殻に入っている反応に関わる電子を価電子と呼びます。この外側の電子が結合や反応に使われるため、価電子の数が同じだと化学的な性質も似てきます。
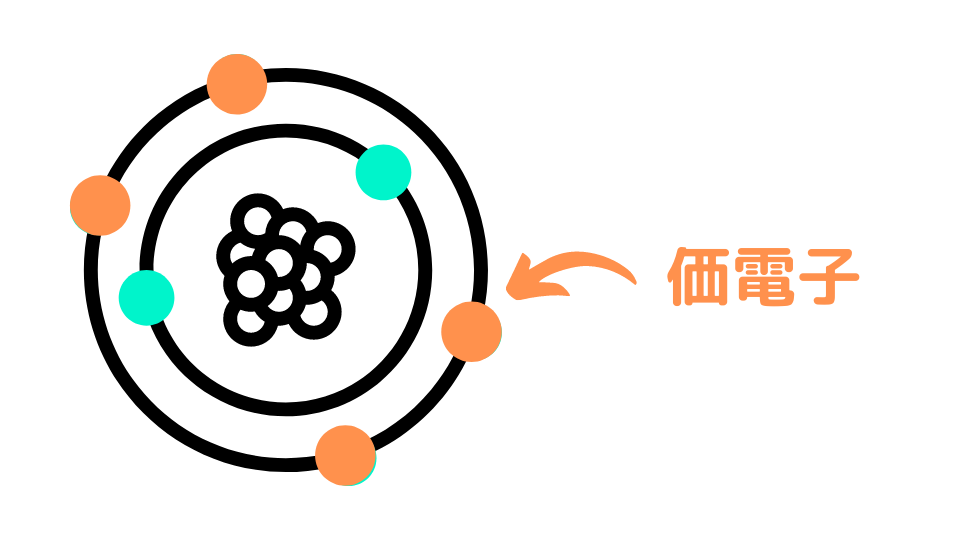
希ガス元素(18族元素)は、電子殻が満タンであり、殆ど反応しないことから価電子は0とします。

あくまで「反応に関わる電子」が価電子なんだね。