化学平衡とは下の反応が同時に起こり、平衡に達した状態を指します。
A+B→C
C→A+B
これをひとまとめにすると、以下のようになります。
A+B⇔C
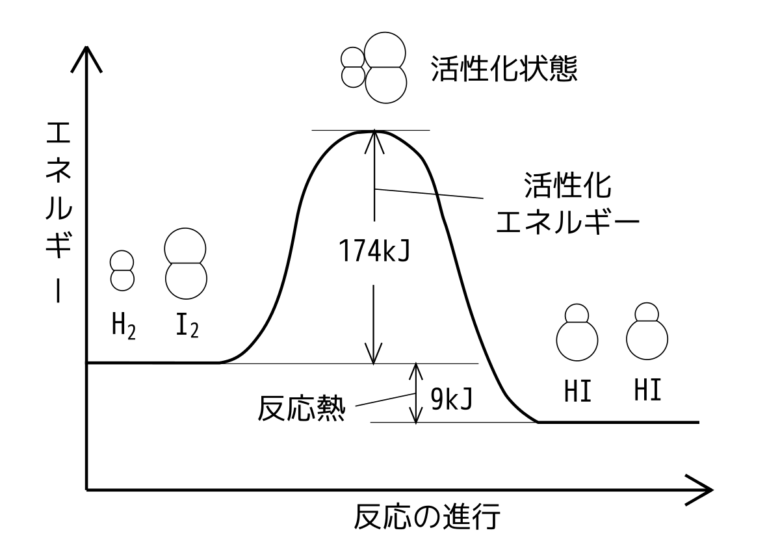
右向きへと向かう反応を正反応、左向きへと向かう反応を逆反応と言い、正反応・逆反応どちらにも進む反応を可逆反応と呼びます。密閉容器におけるH2とI2によるHIの生成反応が有名です。
H2 + I2 ⇔ 2HI
H2とI2の反応熱は比較的小さいです。
H2 + I2 = 2HI + 9kJ
そのため、HIは再びH2とI2に戻りやすく逆反応が起こりやすい反応となっています(活性化エネルギー+9kJで逆反応が起こる)。
H2 + I2 ← 2HI
密閉した容器の中では、HI分子同士の衝突によって活性化エネルギーが与えられ逆反応が起こります。ちなみに、密閉していなければどんどん分子は拡散し逆反応は起こりません。

逆反応に必要なエネルギーの小ささに加えて、エントロピー(乱雑さ)も逆反応に関わることがあるよ アンモニアの生成(化学平衡)
ふつうは硫酸と亜鉛が反応して水素が発生する化学反応は、化学平衡を起こさないものとして理解されています。
H2SO4 + Zn → ZnSO4 + H2↑
しかし、この反応を超頑丈な密閉容器内で行えば、水素が超高圧に達し逆反応が起こり始めます(普通の容器ならば破壊されておしまいですが…)。そう考えると、密閉された容器と十分な反応物があれば、全ての化学反応は可逆反応をおこし、化学平衡に達する可能性があると言えます。
H2SO4 + Zn ⇔ ZnSO4 + H2 (超特殊な環境下のみ)

生成物が超高密度に存在したら何でも逆反応は起こるけど…ふつうは常識的な範囲で考えるということだね。