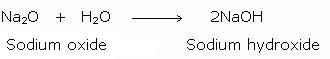
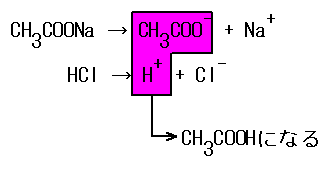塩(えん)の水溶液
塩は酸と塩基の中和反応によって生成されたものである。中和反応を経たのであるから、その塩は中性であると勘違いし易いが、実際はそうではない。強酸・弱酸、強塩基・弱塩基の組み合わせの違いによって液性も変化する。
強い方の液性が出る。
- 弱酸と強塩基の塩:塩基性
- 強酸と弱塩基の塩:酸性
- 強酸と強塩基の塩:中性
- 弱酸と弱塩基の塩:中性
塩の加水分解
塩の水溶液が必ずしも中性でないのは、塩が水と反応(加水分解)してしまうことによる。
弱酸と強塩基の塩
例えば、酢酸CH3COOHとNaOHの反応では、CH3COONaが生成される。
CH3COONaは、水溶液中ではCH3COO-とNa+に電離している。酢酸は元々弱酸であるため、電離度が低く、イオンの状態でいるよりはCH3COOHの状態でいた方が居心地が良い。そのため、水と反応して、一部がCH3COOHに戻る。
その結果、水溶液中にOH-の割合が若干増え、水溶液は塩基性となる。
強酸と弱塩基の塩
上記の反応とは逆に、塩基由来のイオンが水と反応する。その結果、水溶液中にH+が増え、水溶液は酸性になる。
強酸と強塩基の塩
水との反応は起こらない。そのため水溶液は中性となる。
弱酸と弱塩基の塩
酸由来のイオンと、塩基由来のイオンが水と反応する。H+、OH-どちらも増えるため水溶液は中性となる。
酸性塩の液性
塩の一部にHが残っているものを酸性塩と呼ぶ。酸性塩の中には、水溶液が酸性になるものもあれば、塩基性になるものもある。
硫酸水素塩
液性は酸性になる。
HSO4 ⇔ H+ + SO42-
炭酸水素塩
液性は塩基性になる。
HCO3– + H2O ⇔ H2CO3 + OH-