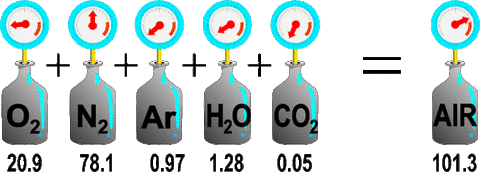全圧と分圧
混合気体(色々な気体が混ざっている)が持つ全体の圧力を全圧と呼び、その中のそれぞれの気体が持つ圧力を分圧と呼ぶ。分圧は全圧にモル分率を掛けることによって求めることができる。
モル分率
混合気体の物質量に対する各成分気体の物質量をモル分率と呼ぶ。分圧を求めたい気体の物質量÷全体の物質量で求めることができる。例えば、気体Aと気体Bの混合気体があったとき、モル分率は次のように求められる(nA=気体Aのモル数、nB=気体Bのモル数)。
気体Aのモル分率 = nA / (nA + nB)
気体Bのモル分率 = nB / (nA + nB)
また、同温同圧では、物質量の比=体積の比となる。そのため、モル分率は各成分気体の体積の割合によっても求めることができる。つまり体積分率=モル分率となる。
例題①
H2(1mol)とO2(1mol)の混合気体が2molある。全体の圧力は1013hpaである。H2のみの圧力(分圧)は次の式で求められる。
全圧×モル分率=分圧
1013hpa×(1mol / 2mol) = 506.5hpa
例題②
窒素と水素の混合気体がある。窒素の分圧は400hpa、水素の分圧は600hpaである。水素のモル分率は次の式で求められる。
全圧×モル分率=分圧の式を変形すると、
分圧 / 全圧=モル分率
600hpa / 1000hpa = 0.6
ドルトンの分圧の法則
混合気体の全圧は、それぞれの気体の分圧の和に等しい、という法則。
P(全圧) = PA(気体Aの分圧) + PB(気体Bの分圧) + ・・・
例題
H2とO2の混合気体がある。それぞれの分圧は0.5atmと0.3atmである。全圧は次の式で求められる。
0.5atm + 0.3atm = 0.8atm(全圧)
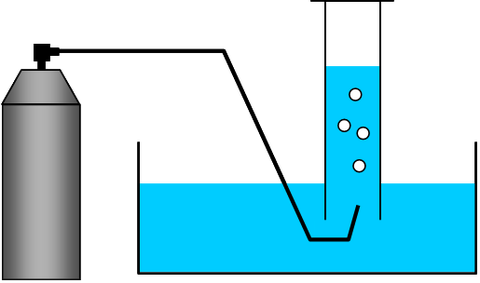
水上置換と分圧
水上置換法で集めた気体は、蒸発した水が捕集瓶内に混入するため、必然的に水蒸気との混合気体となる。また、捕集瓶内の水面と水槽内の水面を一致させてから体積を測定しないと、水柱による圧力を補正し直さなければいけないので注意する必要がある。
大気圧 = 捕集した気体の分圧 + 水蒸気圧
例題①
27℃の環境で水上置換法を用いて水素を捕集した。捕集容器内の水面と、水槽内の水面を一致させてかたところで体積を測定すると100mlだった。大気圧は1000hpaであった。27℃での水蒸気圧を36hpaとすると、水素の分圧は何hpaか。
大気圧 = 水素の分圧 + 水蒸気圧
1000hpa = X + 36hpa
X = 964hpa
例題②
上記の問題で、水素の物質量は何molか。
PV = nRTを変形すると、n = PV / RTになるので、
n = (9.64×104×0.350) / ( 8.3×103×(273 + 27) ) = 0.0136 mol
大気圧 = 水素の分圧 + 水蒸気圧
1000hpa = X + 36hpa
X = 964hpa
例題②
上記の問題で、水素の物質量は何molか。
PV = nRTを変形すると、n = PV / RTになるので、
n = (9.64×104×0.350) / ( 8.3×103×(273 + 27) ) = 0.0136 mol