中和とは
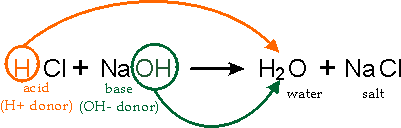
中和とは、酸と塩基が塩を形成する化学反応である酸が持つH+と、塩基が持つOH-が同じ量だけある時に、酸性・塩基性の性質が失われる現象である。
中和の量的関係
中和における酸と塩基について、次の式が成り立つ。どの式も最終的にはH+の量=OH-の量を示している。
H+の物質量 = OH-の物質量
酸の価数×酸の物質量(mol)= 塩基の価数×塩基の物質量(mol)
酸の価数×酸のモル濃度(mol/L)×体積(L) = 塩基の価数×塩基のモル濃度(mol/L)×体積(L)
弱酸(弱塩基)と強塩基(強酸)の中和
中和は酸や塩基の強弱に関係なく起こる。例えば、CH3COOHは、電離度小さいため、殆ど電離していないため弱酸である。そこにNaOHなどの強塩基を加えると、中和反応が進み、H+が消費される。すると、またごく僅かなCH3COOHが電離平衡を保つために電離する。これが繰り返されると、すべてのCH3COOHは電離し、中和される。
CH3COOH+NaOH→CH3COONa+H2O
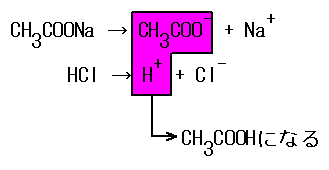
You’ve really imreesspd me with that answer!