強酸 ・ 弱酸と強塩基 ・ 弱塩基
酸の中には、酸性が強い強酸と酸性が弱い弱酸がある。また、塩基にも塩基性が強い強塩基と、塩基性が弱い弱塩基がある。
強酸
塩酸 HCl
臭化水素 HBr
ヨウ化水素 HI
硝酸 HNO3
硫酸 H2SO4
弱酸
フッ化水素 HF
酢酸 CH3COOH
硫化水素 H2S
シュウ酸 (COOH)2
強塩基 (1族と2族の金属からなる塩基が多い)
水酸化ナトリウム NaOH
水酸化カリウム KOH
水酸化カルシウム Ca(OH)2
水酸化バリウム Ba(OH)2
弱塩基
アンモニア NH3
水酸化マグネシウム Mg(OH)2
水酸化銅(Ⅱ) Cu(OH)2
水酸化鉄(Ⅱ) Fe (OH)2
電離度
酸と塩基の強弱は、H+やOH-がどれくらい電離しているかの違いによって生じる。この電離している割合を電離度と呼ぶ。
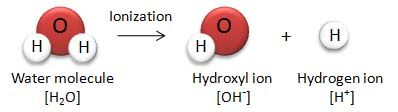
電離
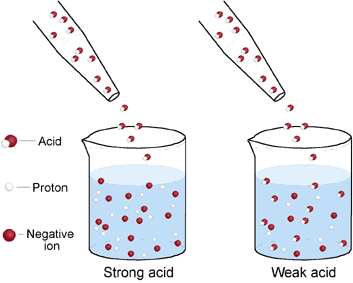
例えば、HClは水溶液中でほぼ100%H+とCl-に電離している。H+の割合が多いため、酸性が強くなり、強酸となる。一方、CH3COOHはH+とCH3COO-に電離している分子は少ない。そのため、酸性(H+の持つ性質)が弱く、弱酸となる。下画像では左:強酸、右弱酸。
電離度は次の式で求めることができる。

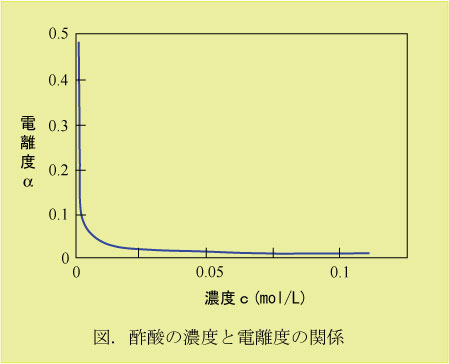
電離度と濃度
強酸はどのような濃度であっても 電離度は1(100%電離)であるが、弱酸はその溶液の濃度によって電離度は変化する。弱酸の場合、溶液の濃度が薄ければ薄いほど電離度は1に近づく(詳細は化学の電離平衡で)。
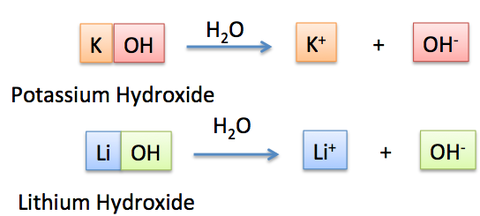
アンモニアのところナトリウムになってますよ
ちゃんとしてください
すみませんミスでした;w;ご指摘いただきありがとうございました。