配位結合
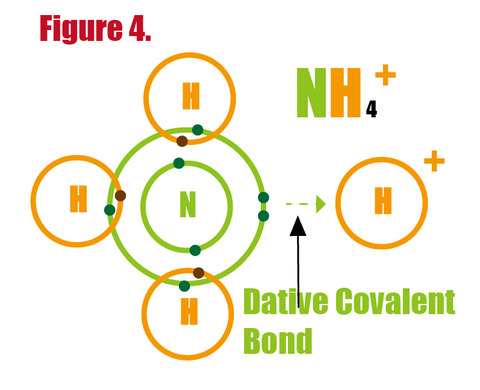
非共有電子対(他の原子と共有結合していない電子)を他のイオンに与えて作る共有結合を配位結合と呼ぶ。例としてアンモニアと水素イオンの配位結合などがある。 配位結合も実質的に共有結合と差は無い。
アンモニウムイオンは配位結合で出来るhttp://mind42.com/
錯イオン
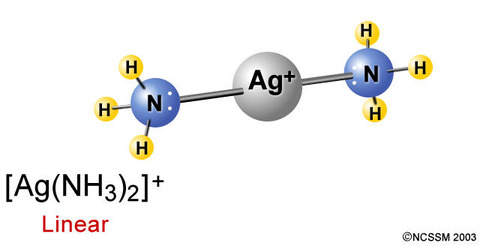
分子やイオンが金属イオンと配位結合してできるイオンを錯イオンと呼ぶ。例えば、アンモニア と銀イオンが配位結合すると、ジアンミン銀イオンとなる。
NH3とAgの配位結合https://www.blendspace.com/
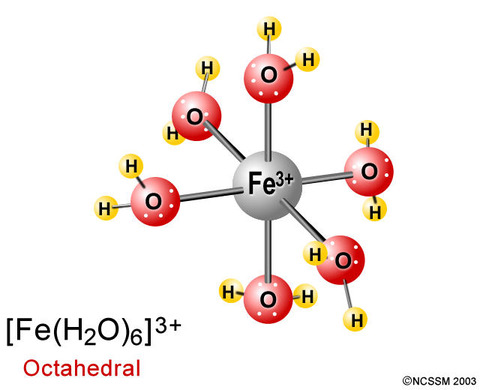
また、水と配位結合する錯イオンをアクア錯イオンと呼ぶ。
ヘキサアクア鉄(Ⅲ)イオンhttps://www.blendspace.com/
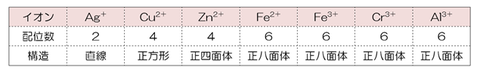
金属原子の周囲にある分子orイオンを配位子と呼び、その数を配位数と呼ぶ。配位数は大体金属の価数×2となっているが、決まっているわけではない。配位数は1つの金属に複数個あると考えて良いが覚えておくべき代表的なものは以下の表である。
錯イオンの名称
配位子(非共有電子対を提供する分子)の個数+配位子の名称+金属イオン名称が錯イオンの名称となる。
配位子の名称
配位子の名称には次の種類がある。
- NH3アンミン
- H2Oアクア
- OH-ヒドロキシド(ヒドロキソ)
- CN-シアニド
- Cl-クロリド(クロロ)
- Br-ブロミド(ブロモ)
配位子の数
また、配位子の数の数え方は次の通りである。
- 2:ジ
- 3:トリ
- 4:テトラ
- 5:ペンタ
- 6:ヘキサ
- 7:ヘプタ
- 8:オクタ
- 9:ノナ
- 10:デカ
これらを合わせると、例えば[Fe(CN)6]3-ならば、ヘキサシアニド鉄(Ⅲ)イオンとなる。
ヘキサシアニド鉄(Ⅲ)酸イオンではないのですか?
配位子が陰イオンですので、ヘキサシアニド鉄(Ⅲ)酸イオンですね
実際こんなの余裕wwwwwww
わかる