ダニエル電池とは
起電力1.1Vの電池である。構造は以下の通りである。
(-) Zn | ZnSO4 aq | CuSO4 aq | Cu (+)
負極(酸化)反応
Zn → Zn2+ + 2e–
正極(還元)反応
Cu2+ + 2e– → Cu
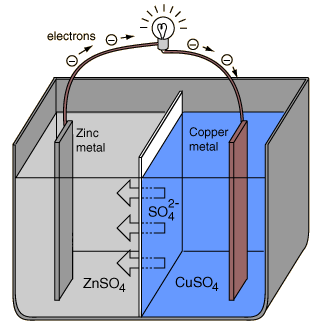
ダニエル電池の特徴として、素焼きを使ってしきりを作っている。もちろん、素焼きの孔からイオンは移動できる。この方法では脱分極を防ぐことができ、安定した電力を供給できる。
http://hyperphysics.phy-astr.gsu.edu/
放電すると電子の移動に伴って、ダニエル電池の電解質中では硫酸亜鉛水溶液では亜鉛が溶け出すので+に帯電する。一方、硫酸銅(Ⅱ)水溶液ではCu2+がCuへと還元されていって陽イオンが減少するため-に帯電する。その結果、陰イオンのSO42-がZnSO4aqの方へ、陽イオンのZn2+がCuSO4aqの方へへと移動していく。
もし、両水溶液間をガラス板のようなもので仕切ってしまうと、亜鉛板の電子は周囲の陽イオンに電子が引きつけられて動けなくなる。一方、銅板では周囲の陰イオンによって電子の移動が妨げられるようになる。その結果、電池として機能しなくなっていまう。
素焼きの板の役割
素焼きの板はZnSO4aqとCuSO4aqの拡散による混合を防ぐ働きを持つ。両水溶液を混合させた場合、亜鉛板では次のような反応が起こる。
Zn + Cu2+ → Zn2+ + Cu
結果、電子が導線を通らずに1つの電極のみで酸化還元反応が完結する自己放電が生じる。ダニエル電池ではCu2+が拡散しづらく、上記のような反応は起こりづらい。しかし、長時間たつと素焼きの板の穴からCu2+が徐々にZnSO4aqの方へと移動し、上記の反応が起こり、次第に電圧が下がっていく。
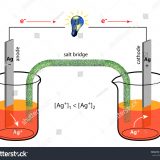
塩橋を使ったダニエル電池
イオンを多く含む水溶液などで両極の電解質を繋ぐものを塩橋と呼ぶ。塩橋で繋いだものもダニエル電池である。
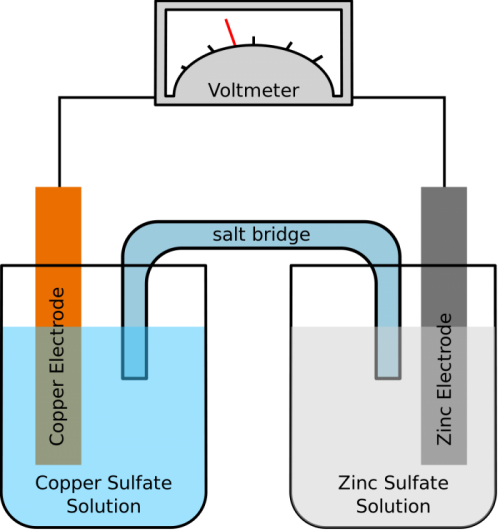
塩橋ではKCl水溶液(K+、Cl-)がゼラチン状物質に含まれており、イオンが移動できる。水溶液中のK+とCl–の動きやすさはほぼ同じ等しいため、長時間放電を続けても両極間でのイオンの偏りは起こらず、分極が生じない。
ちなみに、Zn2+とSO42-は水溶液中では移動速度が異なり、塩橋ではなく素焼き板で仕切りを作って放電を続けているダニエル電池ではイオンの偏りが生じる。このような両溶液間での電位の差を液間電位と呼び、液間電位が生じるとイオンの動きがさらに遅くなり、分極が生じる。