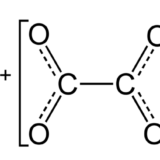
電離定数の計算では電離度αは1より十分に小さく、1-α≒1として計算して良いことになっています。
十分に小さいといってもα<0.05ぐらいの値です。1-α=1で計算して本当に大きな影響は出ないのでしょうか。計算して試してみましょう。

ものは試し!計算してみよう!
酢酸の平衡状態を考えてみましょう。
CH3COOH ⇔CH3COO– + H+
CH3COOHの始めの濃度をc、電離度をαとすると、平衡時の各濃度は次のように表せます。
CH3COOH = c(1-α)、CH3COO– = cα、H+ =cα
電離平衡の式に代入してみましょう。
Ka = [CH3COO-][H+] / [CH3COOH]
= cα × cα / c(1 – α)
= cα2 / 1-α
試しにc=1.0mol/L、α=0.050で計算してみましょう。
Ka = cα2 / 1-α
= 1.0×0.050×0.050 / 1-0.050
=2.63157…×10-3
=2.6×10-3

有効数字2桁でKa=2.6×10-3 、有効数字3桁でもKa=2.63×10-3だね
続いて1-α=1として計算してみましょう。
Ka = cα2 / 1-α
≒ cα2 / 1
= 1.0×0.050×0.050 / 1
=2.5×10-4

やっぱり1-α=1としてしまうと多少の値は変化するね。でも僅かだから1-α=1として計算してしまって良いことになっているんだね。
1-α=1で計算した時はあくまで近似であるということを認識しておこう!

ちなみに電離度は濃度が低くなるほど高くなるよ。電解質が非常に低い濃度の場合には1-α=1にはできなくなるよ。