Contents
電池とは
酸化還元反応に伴って放出されるエネルギーを電気エネルギーとして利用する装置を電池と呼ぶ。

酸化還元反応を同じ場所で生じさせた場合、反応では熱エネルギーが発生するのみである。しかし、電池は酸化反応と還元反応を導線で結んだ別々の場所で行なうことによって、電子の移動が生じ、電流(電気エネルギー)が生じさせることができる。
電池の構造
最も単純な電池の構造は、イオン化傾向の異なる2種類の金属を導線で結び、電解質水溶液に浸したものである。イオン化傾向が高い金属から低い金属側へ電子が流れる。電解質に浸した各金属のことを電極と呼ぶ。
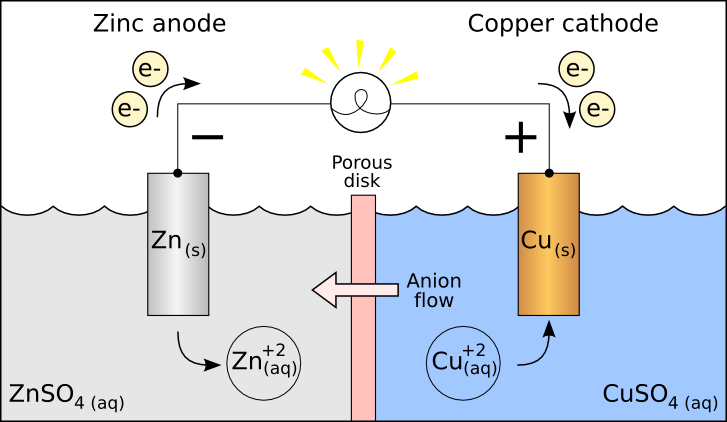
電池の原理(仕組み)
イオン化傾向の大きい金属Aは、溶液中ではイオンとなって溶けやすい。この反応が進んだ場合、金属A内では電子が過剰になってしまう。この状態を電位が低いと呼び、この電極を負極と呼ぶ。
一方、イオン化傾向が低い金属Bでは、溶液中にイオンとして溶けにくいので、電子はそこまで多くない。この状態を電位が高いと呼び、この電極を正極と呼ぶ。
この両者を導線で結ぶと、電子過剰の金属Aから、電子が少ない金属Bへと導線を伝って電子が溢れ出す。これが電流である。
金属Aから電子が金属Bへと流れ出すと、金属Bでも電子が過剰となり、溶液中の金属などの陽イオンなどに電子を受け渡す反応が起こり、単体などが析出し始める。
起電力
イオン化傾向が大きければ大きいほど電子を放出しやすく、その状態を電位が低いと呼ぶ。また、逆の状態は電位が高いと呼ぶ。この高低の差を電池の起電力(V)と呼ぶ。
電池の起電力は、電池に電圧計をつないで計った値とは一致しない。それは、回路に流れる電流の値が大きくなるほど、内部抵抗Rによる電圧降下が大きくなるためである。
起電力と電圧の違い
上記の説明の通り、電池の起電力と電池の電圧は別物である。電池の起電力とは純粋に正極と負極間のイオン化傾向に依存する電圧である。
一方、電池の電圧とは実際に導線を通る際に抵抗がかかり電圧が低下するなどの影響も含めた電圧の値のことである。