全然違うけど混乱の原因になる2つの反応
高校化学では酸と塩基の反応を学んだ後に、酸化還元反応を学習します。その過程で、両者がごっちゃになることが多いです。2つの反応にはどんな違いがあるのでしょうか。
酸と塩基の反応を一言で言うならば「パートナーの取り換えっこ」です。NaOHとHClの中和反応を見てみましょう。
NaOH + HCl → NaCl + H2O
NaOHとHClは水溶液中では図のように電離しています。
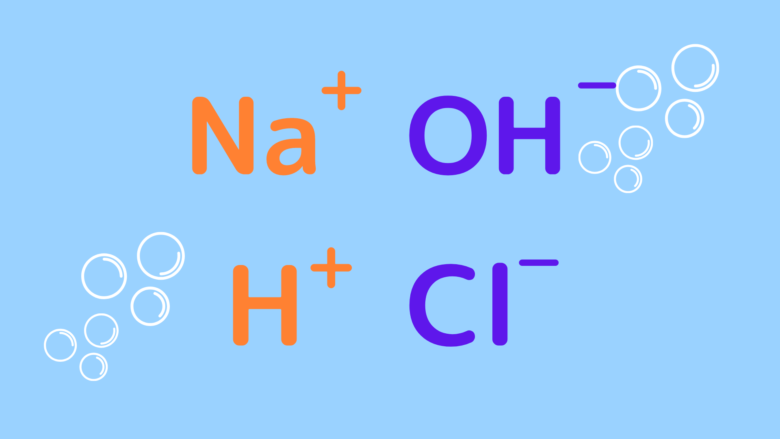
H+とOH–はH2Oとなった方が安定するので結合してH2Oが生成されます。
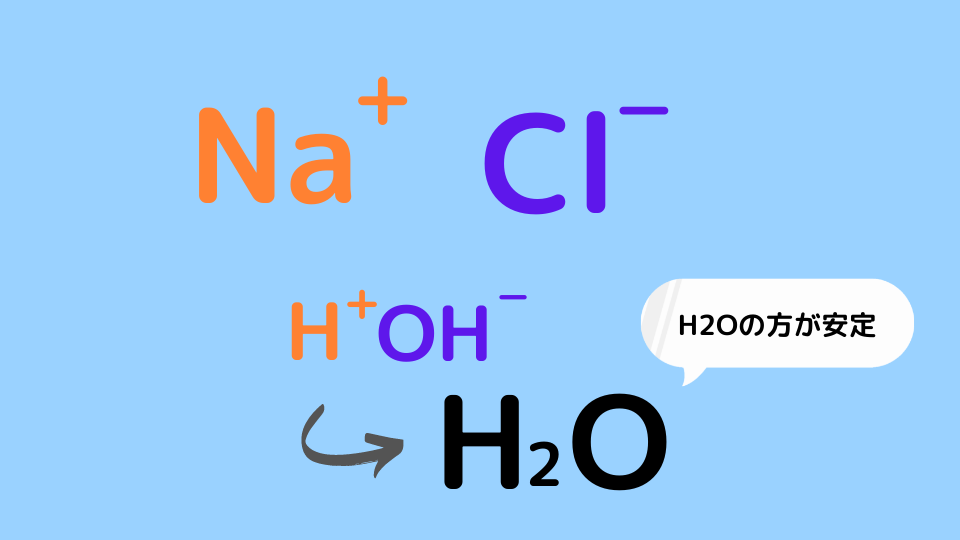
水は僅かに電離する物質です。
H2O ⇔ H+ + OH–
水の電離度は非常に小さく反応は左向きに傾いています。そのため、塩基からOH–、酸からH+が供給されると、すぐにH2Oとなってしまうのです。
ここまでの反応を見てみると、酸と塩基の反応は結合していたパートナーを取り換えっこする反応だと言えます。

中和反応だけじゃなく、弱酸の遊離反応を見てみましょう。
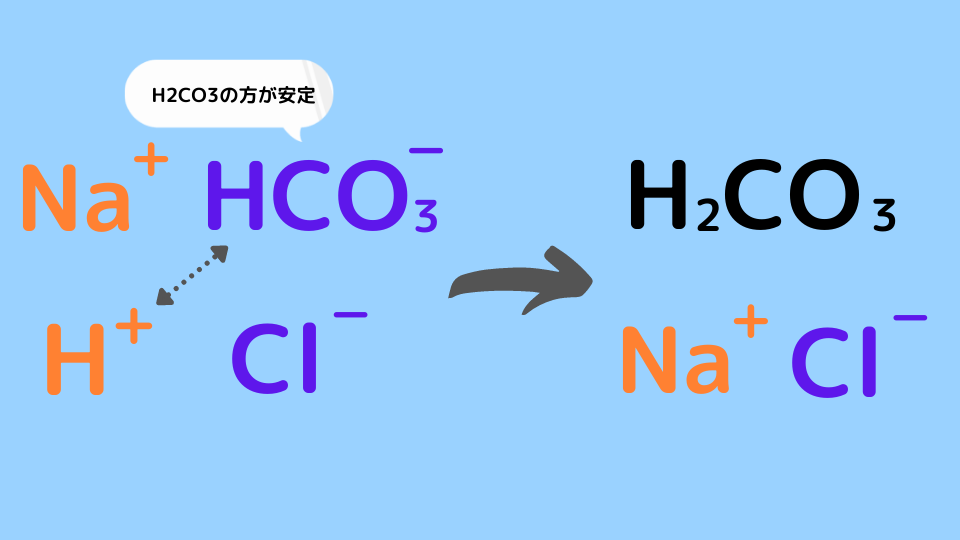
例えば炭酸水素ナトリウムNaHCO3 に塩酸HClを加えると次の反応が起こります。
NaHCO3 + HCl → NaCl + H2CO3
水溶液中ではそれぞれの物質は電離して存在します。炭酸は弱酸なのでイオンの状態HCO3–よりも炭酸分子H2CO3になった方が安定します。その結果、取り換えっこが起こります。

酸と塩基が関わる反応は「パートナーの取り換えっこ」だということがわかったね。
一方、酸化還元反応を一言でいうと「電子をあげたいヤツと電子が欲しいヤツが出会う反応」です。金属ナトリウムNaと塩素Cl2の反応を見てみましょう。
金属ナトリウムNaを構成するNaは価電子1個の金属元素で、価電子を手放したくて仕方がない原子です。一方、塩素Cl2を構成しているCl原子は価電子7の元素で、Cl同士で共有結合を作っていますが、できるならば完全に電子を電子殻に入れたいと思っている原子です。
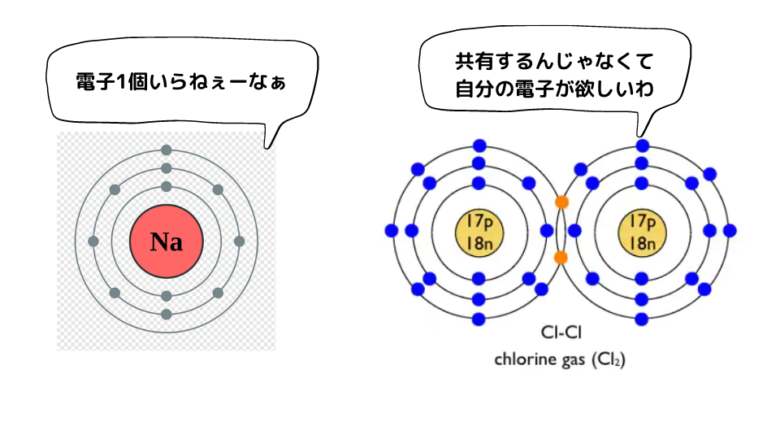
そんな「電子をあげたいヤツ」と「電子を欲しいヤツ」が出会うと、次のような反応が起こります。
電子をあげる反応 Na → Na+ + e–
電子をもらう反応 Cl2 + 2e– → 2Cl–
反応の結果、それぞれがイオンになるのでイオン結合が起こります。
Na+ + Cl– → NaCl
化学反応式にすると…
2Na + Cl2 → 2NaCl
電子を失うことを酸化、電子を得ることを還元と呼ぶので、これを酸化還元反応と言います。
また、世の中にはNaやCl2のように無性に電子をあげたがったりもらいたがったりする物質が存在します。酸化還元反応はそんなヤツらが出会うことによって起こる反応なんです。
酸と塩基の反応は「お互いにパートナーを交換する反応」でした。一方、酸化還元反応は「電子をあげたいヤツともらいたいヤツが出会って電子が移動する反応」です。全く違う反応ですね。
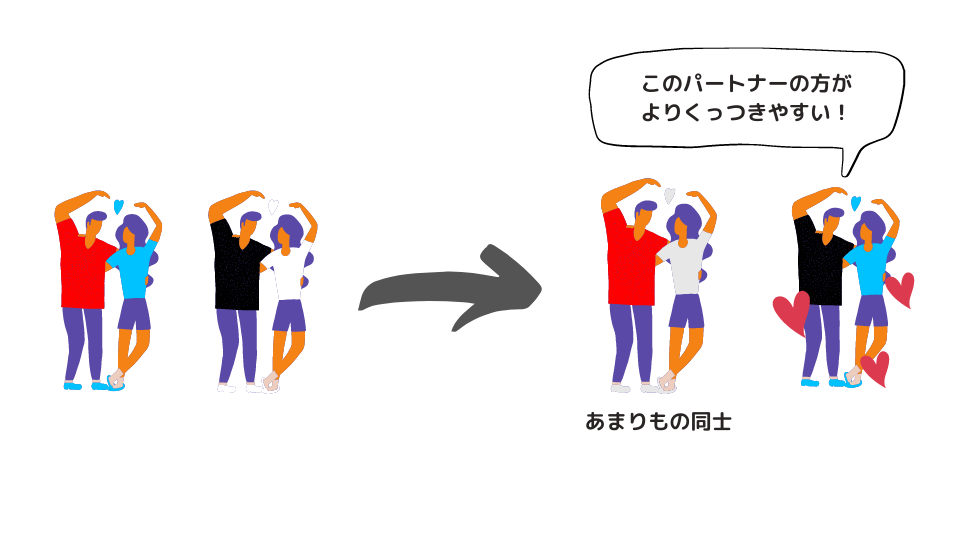
もっと砕いて説明すると、中和反応はくっつきやすい者同士でパートナーを組みなおすイメージですね。組み合わせが変わっただけで、酸化還元反応のような電子の移動はありません。
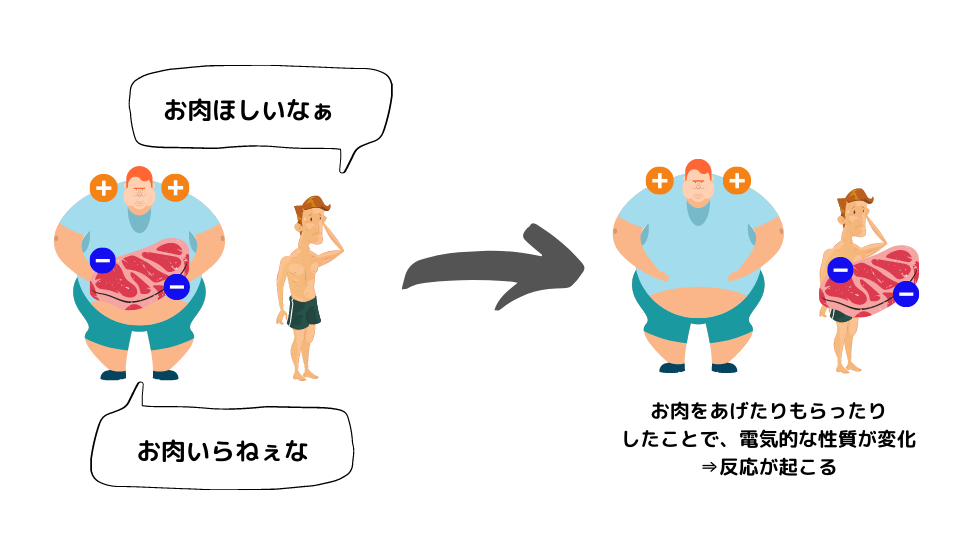
酸化還元反応は、電子をお肉とすると(?)、お肉をあげたい人とお肉をもらいたい人が出会って、お肉をあげた結果、電気的な性質が変化して起こる反応ですね。

両者の違いをしっかり押さえれば、化学の学習はもっと楽しくなるよ!