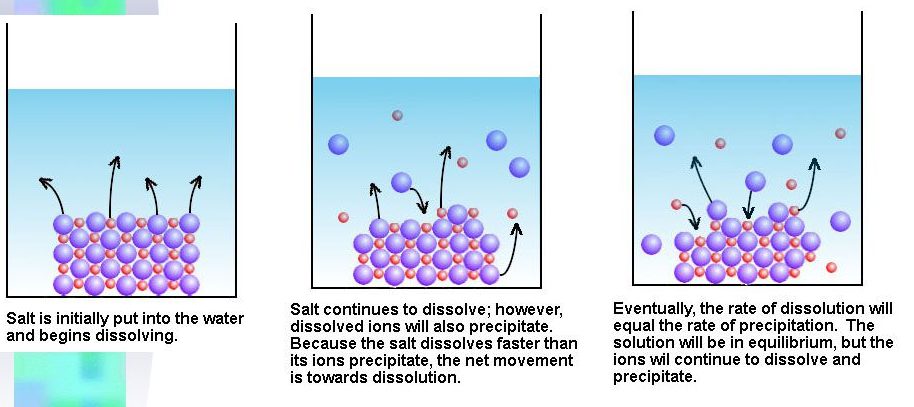
例えば、塩化銀AgClのような水に溶けにくい塩もごく僅かに水に溶けており、溶解平衡が成立しています。
K = [Ag+][Cl–] / [AgCl(固)]
溶解するのは固体のごく一部であり、溶液中の中の固体の濃度はほぼ変化せず一定です。そのため、K[AgCl(固)]は一定であると考えることができます。 そのため、K[AgCl(固)] = Kspとなります。
K[AgCl(固)] = Ksp = [Ag+][Cl–]
つまり、Kspは固体が存在する時のみに成立する値であり、固体が存在しないときには全く意味をなさない値となります。

逆に言えば、Kspの値を基準として固体が析出するかどうかを計算することができるね。