モノボランBH3は次のような電子配置をしています。

Hは閉殻していますが、Bは電子が周囲に6個しかありません。そのため、モノボランはとても不安定な物質で単独ではあまり存在しません。そのため、アンモニアなどと配位結合をしています。

モノボランは通常は二量体であるジボランの形で存在しています。水素-ホウ素間の4個の電子のうち2個は通常とは異なる半結合の形になっています。
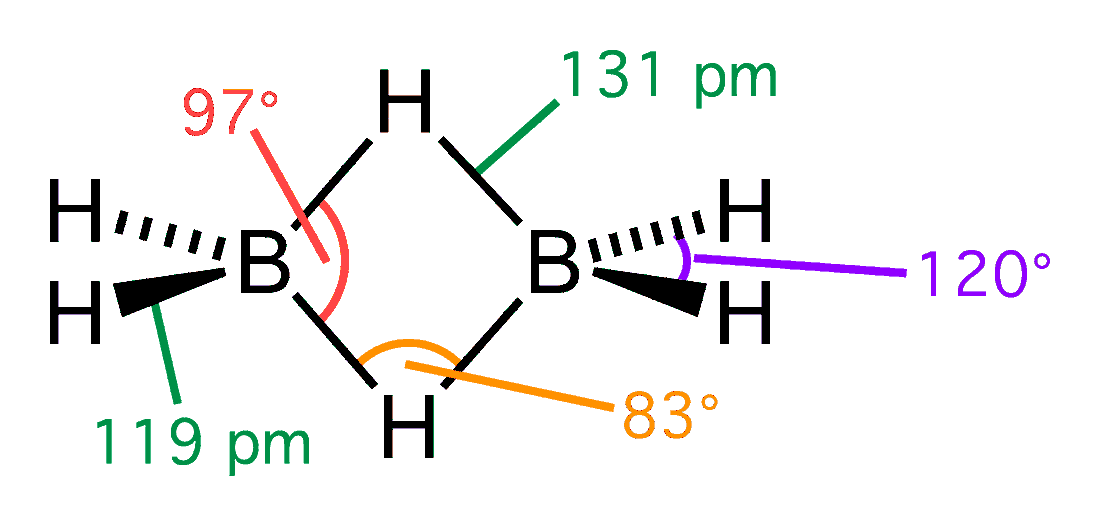

普通に考えたらホウ素の電子が足りていないもんね。
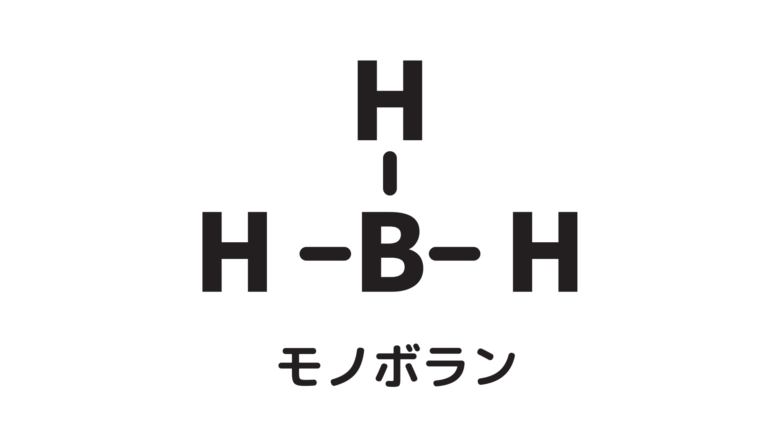
モノボランの構造式は下の通りです。
モノボランBH3は次のような電子配置をしています。

Hは閉殻していますが、Bは電子が周囲に6個しかありません。そのため、モノボランはとても不安定な物質で単独ではあまり存在しません。そのため、アンモニアなどと配位結合をしています。

モノボランは通常は二量体であるジボランの形で存在しています。水素-ホウ素間の4個の電子のうち2個は通常とは異なる半結合の形になっています。


普通に考えたらホウ素の電子が足りていないもんね。
モノボランの構造式は下の通りです。
