アルカリ金属とは
Hを除く1属の金属をアルカリ金属と呼ぶ。Li、Na、K、Rb、Cs、Frの種類がある。「リッチなかーちゃんルビーせしめてフランスへ」と覚えよう。

https://electroncafe.wordpress.com/
アルカリ金属の見た目
アルカリ金属は、軟らかく軽い金属である。密度が小さく、Li,Na,Kは水に浮く。すぐに水や酸素と反応してしまうため、普通は石油等に保存する。ナイフなどで切ることができ、切った瞬間は金属光沢が見られる。
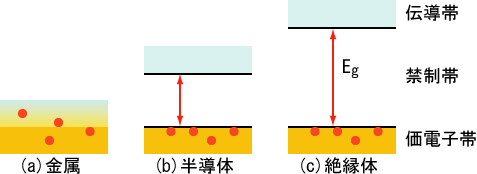
反応性が強い
価電子が1であり、電子を放出して陽イオンになりやすいため、非常に反応性に富んでおり、還元作用(相手に電子を渡す力)を持つ。また、原子番号が大きいほど還元作用(反応性)が強くなる。これは、原子番号ほど最外殻の電子と原子核の距離が遠くなり、電子を引きつける力が弱くなるためである。
塩は水溶性である
アルカリ金属の電子を放出しやすいため、イオンとして非常に安定している。そのため、塩は水溶性であり、あらゆる陰イオンに対して沈殿を生じないことを覚えておこう。
原子番号が大きくなるほど融点は小さくなる
アルカリ金属の融点は次の表の通りである。
| 融点(℃) | |
| Li | 180 |
| Na | 98 |
| K | 63 |
| Rb | 40 |
| Cs | 28 |
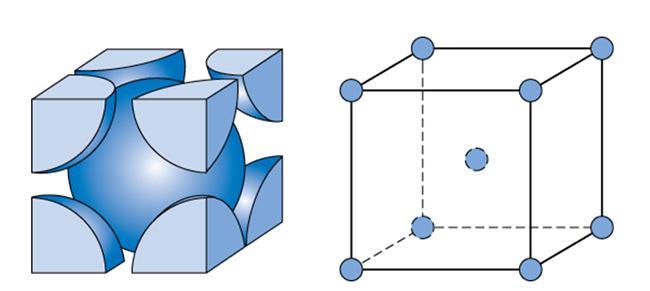
アルカリ金属の価電子は1つであり、原子半径が大きくなるほど、単位面積あたりの自由電子の数が少なくなる。すると、原子半径が大きくなればなるほど、金属結合が弱くなり、融点が低くなる。また、金属結合が弱いため、アルカリ金属はやや隙間の多い体心立方格子の結晶構造となっている。
https://www.e-education.psu.edu/