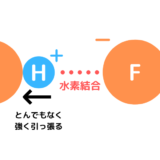
フッ化水素HFは水素結合を作ってH+が電離しないので弱酸ですが、塩酸HClは水素結合を作らず殆どのH+が電離して強酸になります。なぜ塩酸は水素結合をつくらないのでしょうか。

フッ化水素の場合から見てみましょう。
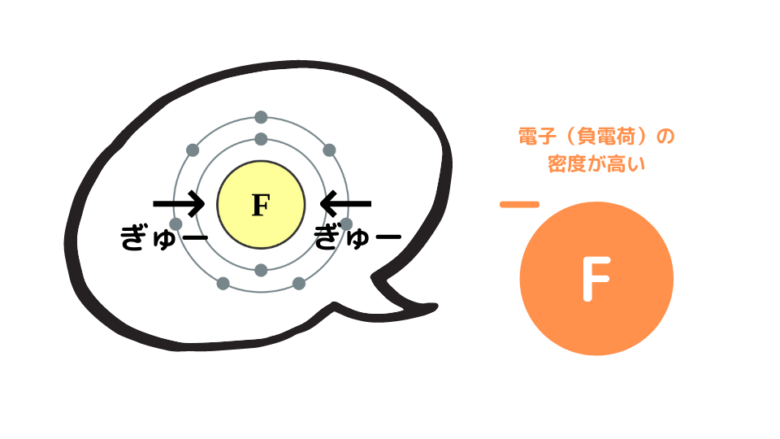
フッ素Fは原子半径が小さく、正電荷を持つ原子核が電子を強く引きつけます。その結果、電子密度が高い状態(負電荷が集中している状態)になります。
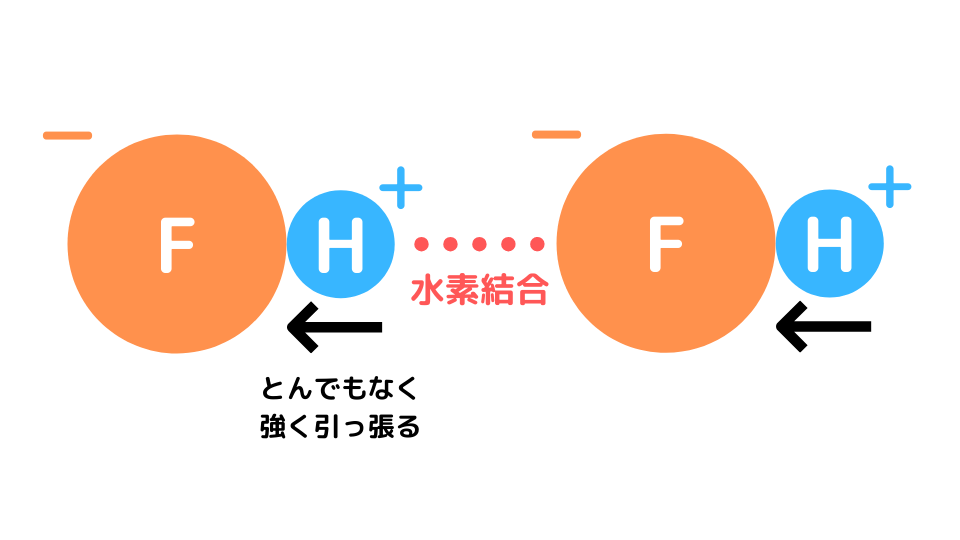
F–は強くH+を引きつけて電離しづらくなります。そして、フッ化水素同士で水素結合を形成します。
一方、塩素Clは原子半径が大きいため、外側の電子が原子核から遠いため、電子密度が大きくなりません。その結果、H+を強く引き付けることはできず電離してしまいます。電離すると水素結合は形成できなくなります。
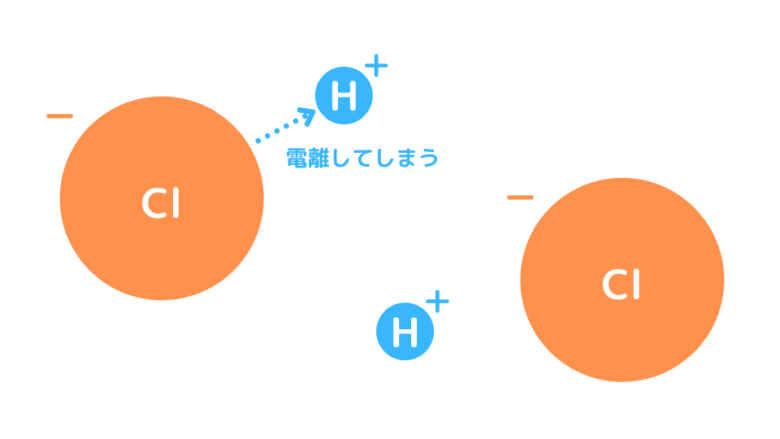

Clは電子が密集してないから、H+を引き寄せられないんだね。